Caratteristiche del vaccino Moderna
Il vaccino COVID-19 Moderna mRNA -1273 è un vaccino destinato a prevenire la COVID-19 nelle persone a partire dai 18 anni. Riportiamo il documento “Riassunto delle caratteristiche del prodotto” di AIFA.
Il documento dell’Agenzia Italiana del Farmaco sul vaccino Moderna
Il vaccino COVID-19 Moderna mRNA -1273 è un vaccino destinato a prevenire la malattia da coronavirus 2019 (COVID-19) nelle persone a partire dai 18 anni di età. Si tratta del secondo vaccino COVID -19 autorizzato da AIFA in Italia (il 7 gennaio 2021), dopo il vaccino Comirnaty. Contiene una molecola denominata RNA messaggero (mRNA) con le istruzioni per produrre una proteina presente su SARS-CoV-2, il virus responsabile di COVID-19.
Il documento “Riassunto delle caratteristiche del prodotto” di AIFA è scaricabile qui.
Composizione qualitativa e quantitativa
Flaconcino multidose contenente 10 dosi da 0,5 mL.
Una dose (0,5 mL) contiene 100 microgrammi di RNA messaggero (mRNA) (inseriti in nanoparticelle lipidiche contenenti il lipide SM-102).
RNA messaggero (mRNA) a singola elica con capping in 5’, prodotto mediante trascrizione in vitro senza l’ausilio di cellule (cell-free) dai corrispondenti DNA stampo, che codifica per la proteina virale spike (S) del SARS-CoV-2.
Elenco degli eccipienti:
- Lipide SM-102
- Colesterolo
- 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC)
- 1,2-dimiristoil-rac-glicero-3-metossipolietilenglicole-2000 (PEG2000 DMG)
- Trometamolo
- Trometamolo cloridrato
- Acido acetico
- Sodio acetato triidrato
- Saccarosio
- Acqua per preparazioni iniettabili
Forma farmaceutica
Dispersione per preparazione iniettabile. Dispersione di colore da bianco a biancastro (pH: 7,0 – 8,0).
Posologia e modo di somministrazione
Soggetti di età pari o superiore a 18 anni
COVID-19 Vaccine Moderna è somministrato come ciclo di due dosi (da 0,5 mL ciascuna). Si raccomanda di somministrare la seconda dose 28 giorni dopo la prima.
Non ci sono dati disponibili sull’intercambiabilità di COVID-19 Vaccine Moderna con altri vaccini anti-COVID-19 per completare il ciclo di vaccinazione. I soggetti che hanno ricevuto la prima dose di COVID-19 Vaccine Moderna devono ricevere la seconda dose di COVID-19 Vaccine Moderna per completare il ciclo di vaccinazione.
Popolazione pediatrica
La sicurezza e l’efficacia di COVID-19 Vaccine Moderna nei bambini e negli adolescenti di età inferiore a 18 anni non sono state ancora stabilite. Non ci sono dati disponibili.
Popolazione anziana
Non è necessario alcun aggiustamento della dose nei soggetti anziani di età ≥ 65 anni.
Modo di somministrazione
Il vaccino deve essere somministrato per via intramuscolare. Il sito preferito è la regione deltoidea del braccio. Non iniettare questo vaccino per via endovenosa, sottocutanea o intradermica.
Il vaccino non deve essere miscelato nella stessa siringa con altri vaccini o medicinali.
Ipersensibilità e anafilassi
È stata segnalata anafilassi. Devono essere sempre immediatamente disponibili un trattamento medico e una supervisione adeguati nel caso di una reazione anafilattica in seguito alla somministrazione del vaccino.
A seguito della vaccinazione si raccomanda un’attenta osservazione per almeno 15 minuti. Coloro che manifestano una reazione anafilattica in seguito alla prima dose di COVID-19 Vaccine Moderna non devono ricevere la seconda dose del vaccino.
Reazioni associate all’ansia
In relazione alla vaccinazione possono verificarsi reazioni associate all’ansia, tra cui reazione vasovagale (sincope), iperventilazione o reazioni associate allo stress, come risposta psicogena all’iniezione dell’ago. È importante che vengano adottate precauzioni per evitare lesioni da svenimento.
Malattia concomitante
In soggetti con malattia febbrile severa o infezione acuta la vaccinazione deve essere posticipata. La presenza di un’infezione minore e/o febbre di bassa entità non deve ritardare la vaccinazione.
Trombocitopenia e disturbi della coagulazione
Come per le altre iniezioni intramuscolari, il vaccino deve essere somministrato con cautela a soggetti che ricevono terapia anticoagulante o sono affetti da trombocitopenia o da qualsiasi disturbo della coagulazione (come l’emofilia), poiché in questi soggetti possono verificarsi sanguinamento o formazione di ematomi in seguito alla somministrazione per via intramuscolare.
Soggetti immunocompromessi
L’efficacia, la sicurezza e l’immunogenicità del vaccino non sono state valutate nei soggetti immunocompromessi, inclusi coloro che ricevono terapia immunosoppressiva. L’efficacia di COVID-19 Vaccine Moderna può risultare diminuita nei soggetti immunosoppressi.
Durata della protezione
La durata della protezione offerta dal vaccino non è nota ed è ancora in fase di determinazione tramite studi clinici in corso.
Limitazioni dell’efficacia del vaccino
I soggetti potrebbero non essere completamente protetti fino a 14 giorni dopo aver ricevuto la seconda dose. Come con tutti i vaccini, la vaccinazione con COVID-19 Vaccine Moderna potrebbe non
proteggere tutti coloro che ricevono il vaccino.
Fertilità, gravidanza e allattamento
Gravidanza
L’esperienza relativa all’uso di COVID-19 Vaccine Moderna in donne in gravidanza è limitata. Gli studi sugli animali non indicano effetti dannosi diretti o indiretti relativamente a gravidanza, sviluppo embrionale/fetale, parto o sviluppo post-natale. La somministrazione di COVID-19 Vaccine Moderna durante la gravidanza deve essere presa in considerazione solo se i potenziali benefici superano gli eventuali potenziali rischi per la madre e il feto.
Allattamento
Non è noto se COVID-19 Vaccine Moderna sia escreto nel latte materno.
Fertilità
Gli studi sugli animali non indicano effetti dannosi diretti o indiretti di tossicità riproduttiva.
Riassunto del profilo di sicurezza
La sicurezza di COVID-19 Vaccine Moderna è stata valutata in uno studio clinico in corso di fase 3, randomizzato, controllato con placebo, con osservatore in cieco condotto negli Stati Uniti su 30.351 partecipanti di età pari o superiore a 18 anni che hanno ricevuto almeno una dose di COVID-19 Vaccine Moderna (n=15.185) o placebo (n=15.166) (NCT04470427). Al momento della vaccinazione l’età media della popolazione era di 52 anni (range 18-95); 22.831 (75,2%) partecipanti erano di età compresa tra 18 e 64 anni e 7.520 (24,8%) partecipanti erano di età pari o superiore a 65 anni.
Le reazioni avverse più comunemente segnalate sono state: dolore in sede di iniezione (92%), stanchezza (70%), cefalea (64,7%), mialgia (61,5%), artralgia (46,4%), brividi (45,4%), nausea/vomito (23%), tumefazione/dolorabilità ascellare (19,8%), febbre (15,5%), tumefazione (14,7%) e arrossamento (10%) in sede di iniezione. Le reazioni avverse sono state normalmente di intensità lieve o moderata e si sono risolte entro pochi giorni. Una frequenza leggermente inferiore di eventi di reattogenicità è stata associata all’età più avanzata.
Complessivamente, l’incidenza di alcune reazioni avverse è stata più elevata nei gruppi di età inferiore: l’incidenza di tumefazione/dolorabilità ascellare, stanchezza, cefalea, mialgia, artralgia, brividi, nausea/vomito e febbre è stata maggiore negli adulti di età compresa tra 18 e <65 anni rispetto a quelli di età ≥65 anni. Le reazioni avverse sistemiche e locali sono state segnalate più frequentemente dopo la Dose 2 piuttosto che dopo la Dose 1.
Efficacia clinica
Nello studio clinico di fase 3, randomizzato, controllato con placebo, con osservatore in cieco (NCT04470427) sono stati esclusi soggetti immunocompromessi o che avevano ricevuto immunosoppressori negli ultimi 6 mesi, nonché partecipanti in gravidanza o con una storia nota di infezione da SARS-CoV-2. Non sono stati esclusi i partecipanti con malattia da HIV stabile. I vaccini antinfluenzali potevano essere somministrati 14 giorni prima o 14 giorni dopo qualsiasi dose di COVID-19 Vaccine Moderna. Era inoltre richiesto che i partecipanti rispettassero un intervallo minimo di 3 mesi dopo aver ricevuto emocomponenti/plasmaderivati o immunoglobuline prima dello studio per poter ricevere placebo oppure COVID-19 Vaccine Moderna.
Sono stati osservati 30.351 soggetti in totale, per un periodo mediano di 92 giorni (range: 1-122), per l’insorgenza di COVID-19.
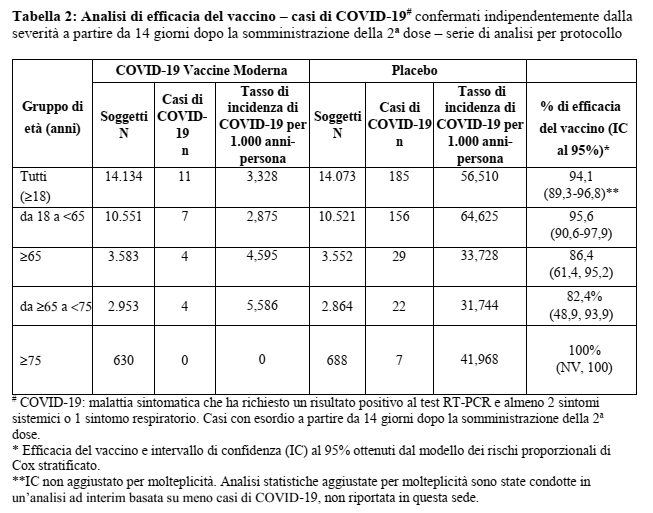
La popolazione per l’analisi di efficacia primaria (di seguito indicata come serie di analisi per protocollo, PPS) ha compreso 28.207 soggetti che hanno ricevuto COVID-19 Vaccine Moderna (n=14.134) o placebo (n=14.073) e che erano negativi al SARS-CoV-2 al basale. La popolazione dello studio per la PPS era per il 47,4% di sesso femminile e per il 52,6% di sesso maschile, per il 79,5% bianca, per il 9,7% di etnia afro-americana, per il 4,6% asiatica e per il 6,2% di altre etnie. Il 19,7% dei partecipanti si era identificato come ispanico o latino. L’età mediana dei soggetti era di 53 anni (range:18-94). Per l’inclusione nella PPS era consentita una finestra di dosaggio da -7 a +14 giorni per la somministrazione della seconda dose (programmata al giorno 29). Il 98% di coloro che hanno ricevuto il vaccino ha ricevuto la seconda dose da 25 a 35 giorni dopo la dose 1 (corrispondenti a una finestra da -3 a +7 giorni intorno all’intervallo di 28 giorni).
I casi di COVID-19 sono stati confermati mediante reazione a catena della polimerasi a trascrizione inversa (RT-PCR) e da un Comitato di validazione clinica.
Tra tutti i soggetti della popolazione PPS non sono stati segnalati casi severi di COVID-19 nel gruppo del vaccino rispetto a 30 casi dei 185 (16%) segnalati nel gruppo placebo. Dei 30 partecipanti con malattia di grado severo, 9 sono stati ricoverati, di cui 2 in un reparto di terapia intensiva. La maggior parte dei restanti casi severi soddisfaceva solo il criterio della saturazione dell’ossigeno (SpO2) per la definizione della malattia di grado severo (SpO2 ≤93% in aria ambiente).
L’efficacia vaccinale di COVID-19 Vaccine Moderna nella prevenzione di COVID-19, indipendentemente da precedente infezione da SARS-CoV-2 (stabilita tramite test sierologico e tampone nasofaringeo al basale) a partire da 14 giorni dopo la Dose 2 era del 93,6% (intervallo di confidenza al 95% 88,5%, 96,4%).
Inoltre, le analisi per sottogruppi dell’endpoint primario di efficacia hanno mostrato un punto di stima dell’efficacia simile tra gruppi suddivisi per generi, gruppi etnici, nonché tra i partecipanti con comorbilità associate a un alto rischio di COVID-19 di grado severo.
Popolazione anziana
COVID-19 Vaccine Moderna è stato valutato in soggetti di età pari o superiore a 18 anni, compresi 3.768 soggetti di età pari o superiore a 65 anni. L’efficacia di COVID-19 Vaccine Moderna è risultata costante tra i soggetti anziani (≥65 anni) e i soggetti adulti più giovani (18-64 anni).
Popolazione pediatrica
L’Agenzia europea dei medicinali ha rinviato l’obbligo di presentare i risultati degli studi con COVID-19 Vaccine Moderna in uno o più sottogruppi della popolazione pediatrica per la prevenzione di COVID-19 (vedere paragrafo 4.2 per informazioni sull’uso pediatrico).
Precauzioni particolari per la conservazione
Conservare congelato in un congelatore a una temperatura compresa tra -25 °C e -15 °C. Non conservare in ghiaccio secco o a temperature inferiori a -40 °C.