L'adroterapia, con precisione contro il cancro
Ancora più efficaci dei protoni contro certi tumori, gli ioni carbonio consentono un'irradiazione massiccia e precisa. Ci parla di adroterapia Pierre Henriquet dottore in fisica nucleare applicata alla medicina.
Adroterapia: cariche pesanti ed estrema precisione contro i tumori radioresistenti
Ancora più efficaci dei protoni contro certi tumori, gli ioni carbonio consentono un'irradiazione massiccia e precisa. Ci parla di adroterapia Pierre Henriquet (alias @astropierre su Twitter), mediatore scientifico specializzato in astronomia e dottore in fisica nucleare applicata alla medicina.
Ci sono tre terapie principali per trattare il cancro, usate da sole o insieme: la chirurgia, la chemioterapia e la radioterapia. Quest'ultima comporta l'uso di radiazioni ionizzanti (principalmente raggi X o fasci di elettroni, ma a volte vengono usate anche fonti radioattive posizionate all’interno dell’organismo) nel trattamento locale o loco-regionale dei tumori. Il principio è quello di fornire la dose prescritta all'area del tumore, preservando il più possibile il tessuto sano circostante.
Tuttavia, nonostante i grandi progressi in termini di qualità e conformazione del fascio, alcuni tipi di tumori cosiddetti "radioresistenti" (~2% dei casi) non possono essere trattati dalla radioterapia convenzionale.
Adroterapia
Esiste un'altra tecnica, che sta diventando sempre più promettente, per trattare soprattutto questo tipo di tumori radioresistenti. L'adroterapia consiste nell'irradiare i tumori non con fasci di raggi X (fotoni) ma con particelle cariche come protoni o ioni di carbonio. La grande differenza tra i fotoni e questi nuclei atomici carichi è il modo in cui questi due tipi di particelle depositano la loro energia nel corpo del paziente.
Mentre la terapia protonica è abbastanza conosciuta - la praticano un centinaio di centri in tutto il mondo - la terapia al carbonio è ancora limitata. Teoricamente, il termine "adroterapia" comprende queste due tecniche. In pratica, si riferisce più specificamente alla seconda.
Precisione ineguagliabile
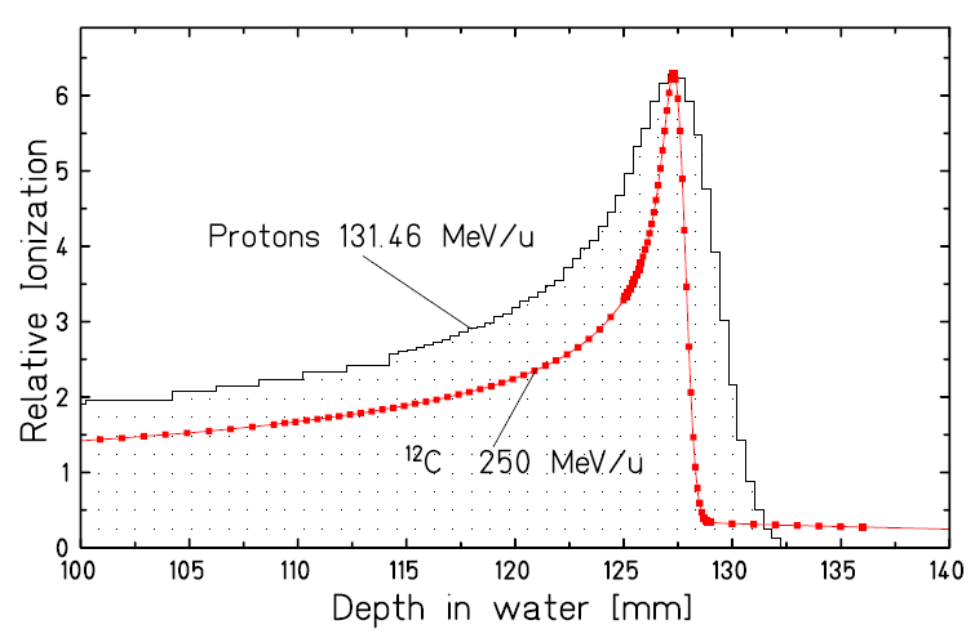
Mentre i raggi X depositano energia lungo tutto il loro percorso, dall'ingresso nel corpo del paziente fino alla sua uscita, le particelle cariche (protoni o ioni di carbonio) penetrano solo fino a una certa profondità e poi si fermano. Questa profondità varia a seconda dell'energia del fascio e dei materiali attraversati.
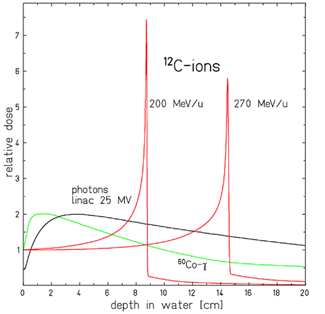
Confronto dei diversi profili di deposizione della dose per 2 fasci di ioni carbonio di diversa energia (rosso) e 2 fasci di raggi X (verde e nero). D. Schardt et al., Reviews of Modern Physics, 82 (2010), 383
Inoltre, la deposizione di energia dei fasci di raggi X è continua, seguendo un profilo leggermente decrescente con la profondità (un singolo fascio deposita quindi più energia vicino alla superficie rispetto alla sede del tumore, in profondità). Le particelle cariche depositano pochissima energia lungo il loro percorso. Ma la loro interazione con la materia che attraversano è caratterizzata da un picco di deposito di energia (chiamato "picco di Bragg") vicino a dove si fermano. Poiché la dispersione spaziale ed energetica degli ioni di carbonio è inferiore a quella dei protoni, a profondità equivalenti il picco di Bragg ottenuto con la terapia al carbonio è ancora più fine che con la terapia che usa i protoni.
Confronto della larghezza del picco di Bragg per un fascio di ioni carbonio e un fascio di protoni sullo stesso percorso. Il picco di Bragg del fascio di protoni è circa tre volte più ampio.
Il vantaggio di questo tipo di irradiazione si comprende facilmente, capace di ridurre considerevolmente la deposizione di energia nei tessuti a monte, quasi di annullarla quasi nei tessuti a valle e di massimizzare la deposizione della dose terapeutica alla profondità precisa in cui si trova il tumore.
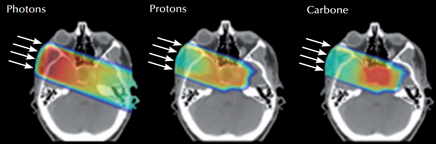
Effetto di un singolo fascio di radiazioni in raggi X (sinistra), terapia protonica (centro) e adroterapia al carbonio (destra). Il tumore è al centro del cranio ©GCS ETOILE
Vantaggi e svantaggi
Prima di tutto, l'adroterapia è particolarmente adatta ai tumori radioresistenti come il colangiocarcinoma nodulare singolo o l'adenocarcinoma pancreatico. Questi tumori possono essere molto sensibili a questa nuova modalità di irradiazione, che viene poi utilizzata in aggiunta alla radioterapia convenzionale.
Un altro vantaggio è la sua precisione balistica. Non solo il fascio di particelle si ferma nel punto del tumore, risparmiando completamente i tessuti a valle, ma questo fascio è anche molto fine, molto più di un fascio di raggi X. Questo rende necessario spostare il fascio durante l'irradiazione per irradiare l'intero volume del tumore punto per punto. Tale precisione ha un valore inestimabile quando si trattano tumori posizionati molto vicini a tessuti sani e radiosensibili, come i tumori spinali e paraspinali: sarcomi, cordomi inoperabili o resecati in modo parziale.
Inoltre, i risultati pubblicati riguardanti l'irradiazione con ioni di carbonio mostrano un'efficienza molto superiore ai trattamenti senza carbonio. Questi risultati riguardavano adenocarcinomi della testa e del collo, melanomi delle mucose, cordomi, sarcomi, epatocarcinomi e recidive pelviche di adenocarcinomi del retto. Infine, l'uso della terapia al carbonio riduce il numero di sedute necessarie (secondo l'esperienza italiana, un trattamento con protoni comporta in media 35 sedute, contro le 16 con gli ioni di carbonio).
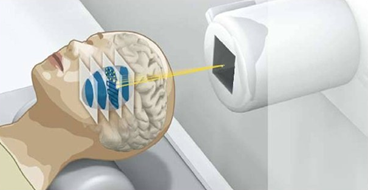
Illustrazione della tecnica "raster scanning" che permette il trattamento dell'intero volume tumorale variando la posizione x,y,z del picco di Bragg ©GSI
Un limite dell'adroterapia è che non permette il monitoraggio in tempo reale di un tumore in movimento, la cui posizione cambia con la respirazione del paziente (polmoni, fegato, pancreas, ecc.). Una soluzione è quella di sottoporre il paziente a una scansione 4D (la quarta dimensione è il tempo di respirazione). Si tratta di "fotografare" l'oscillazione del tumore durante l'inspirazione e l'espirazione. Durante il trattamento, le telecamere a infrarossi seguono il tumore con sensori posti sul paziente e il fascio viene attivato solo quando il tumore è nella posizione in cui può essere raggiunto.
Ma lo svantaggio principale è ovviamente logistico. L'adroterapia con ioni di carbonio richiede la costruzione di un acceleratore di particelle adiacente al centro di trattamento. Serve anche una piattaforma mobile per ruotare il fascio intorno al paziente mantenendo una precisione millimetrica. Una struttura di questa scala è ovviamente una bella sfida, date le esigenze di spazio, le difficoltà tecniche e l'investimento richiesto.
Il costo dell’impianto è una delle ragioni per cui ci sono così pochi centri di trattamento con ioni di carbonio. Ad oggi, in Europa esistono solo quattro centri di adroterapia al carbonio: due in Germania (Heidelberg Ion-beam Therapy Center e Marburg Particle Center), uno in Austria (MedAustron a Wiener Neustadt) e infine il CNAO (Centro Nazionale di Adroterapia Oncologica) in Italia.
Il sincrotrone CNAO, situato in un bunker di 1.600 m2, è separato dal resto dell'edificio da uno scudo antiradiazioni in cemento armato spesso da 2 a 6 metri. I protoni e gli ioni di carbonio sono isolati da campi magnetici prima di subire una prima accelerazione nella parte lineare (lunga 6 metri, in rosa). Poi "girano" nel sincrotrone (80 metri di circonferenza), prima a 30.000 chilometri al secondo e poi al doppio della velocità. Le particelle vengono poi inviate alle tre sale di trattamento ©CNAO

Altrettanto impressionante è il 'Gantry' rotante (blu) a Heidelberg. Supporta parte dell'acceleratore di ioni di carbonio (arancione), permettendo al fascio di ruotare intorno al paziente nella stanza di trattamento (non visibile qui) ©GSI
Tecnica innovativa, l'adroterapia con ioni carbonio è molto efficace per trattare i tumori radioresistenti con geometria complessa o posizionati nel corpo del paziente in siti difficili da raggiungere. Tuttavia, la complessità tecnologica rappresenta un grande ostacolo al suo sviluppo. Anche se il Giappone, pioniere in questo campo, ha già sette centri di trattamento [...].