Le elezioni e il vaccino fast-track
La corsa al vaccino contro il virus SARS-CoV-2 incontra la corsa alle elezioni presidenziali negli Stati Uniti, col risultato che i processi di sviluppo del vaccino diventano oggetto di propaganda politica.
Moderna e Pfizer pubblicano i protocolli delle sperimentazioni dei vaccini contro il coronavirus
La corsa al vaccino contro il virus SARS-CoV-2 incontra la corsa alle elezioni presidenziali negli Stati Uniti, col risultato che i processi di sviluppo del vaccino diventano oggetto di propaganda politica. Le aziende farmaceutiche tentano quindi di riguadagnarsi la fiducia della popolazione e della comunità scientifica pubblicando i protocolli delle sperimentazioni in atto.
Moderna e Pfizer, due aziende farmaceutiche che stanno lavorando allo sviluppo di un vaccino contro il SARS-CoV-2, si sono piegate alle pressioni provenienti da più parti e, abbandonando la loro tradizionale riservatezza, hanno svelato i protocolli completi delle sperimentazioni dei loro vaccini. Hanno rivelato dettagli su come i partecipanti vengono selezionati e monitorati, le condizioni in cui gli studi potrebbero essere interrotti in anticipo in caso di problemi e le prove che i ricercatori utilizzeranno per determinare l’efficacia del vaccino. Lo studio di Moderna coinvolgerà 30.000 partecipanti, quello di Pfizer 44.000.
Le aziende farmaceutiche di solito condividono questi documenti dopo il completamento degli studi. La pubblicazione dei protocolli con gli studi ancora in corso, una rarità, è volta essenzialmente a contrastare il sospetto crescente tra gli americani che gli inviti del Presidente Trump a produrre un vaccino prima delle elezioni del 3 novembre possano portare al rilascio di un vaccino non sicuro.
Il protocollo pubblicato da Moderna prevede si possa aspettare anche fino al prossimo anno per definire l’efficacia del vaccino. Questo contrasta con le previsioni ottimistiche del Presidente, che vuole un vaccino ampiamente disponibile al pubblico già in ottobre. Il protocollo di Pfizer non stima la tempistica della disponibilità dei risultati completi. Il suo amministratore delegato ha però detto ripetutamente che l'azienda spera di avere una risposta già in ottobre. Moderna invece ha detto solo che potrebbe avere un primo risultato entro la fine dell'anno.
Le previsioni di Moderna rispecchiano le stime prudenziali di molti ricercatori, tra cui il Dr. Robert R. Redfield, il direttore del Centers for Disease Control and Prevention, che recentemente ha riferito in Senato che il vaccino potrebbe essere disponibile solo dopo la metà del prossimo anno. Ore dopo, il Presidente Trump lo contraddiceva bruscamente, parlando della disponibilità di un vaccino già tra poche settimane.
Joseph R. Biden Jr., il candidato democratico alla presidenza, ha affermato che il processo utilizzato per valutare e approvare un vaccino deve essere "totalmente trasparente" perché la comunità si fidi. Ha detto che gli appelli di Trump alle aziende e alle autorità di regolamentazione per accelerare il processo hanno scosso la fiducia della popolazione nei vaccini e che la politica non deve avere alcun ruolo nello sviluppo del vaccino.
Il Dr. Tal Zaks, direttore sanitario di Moderna, la prima azienda a pubblicare i dettagli della sua sperimentazione, ha detto che le aziende farmaceutiche erano solitamente riluttanti a farlo, per ragioni di concorrenza. «Sono orgoglioso di farlo» ha detto in un'intervista. «Non credo che in quello che stiamo divulgando ci sia qualcosa che già non è stato reso noto, ma lasciamo che sia la comunità scientifica a giudicare». Pfizer ha dichiarato in un comunicato che di solito non rilascia i suoi protocolli, aggiungendo: «Riconosciamo, tuttavia, che la pandemia di COVID-19 è una circostanza unica e la necessità di trasparenza è chiara».
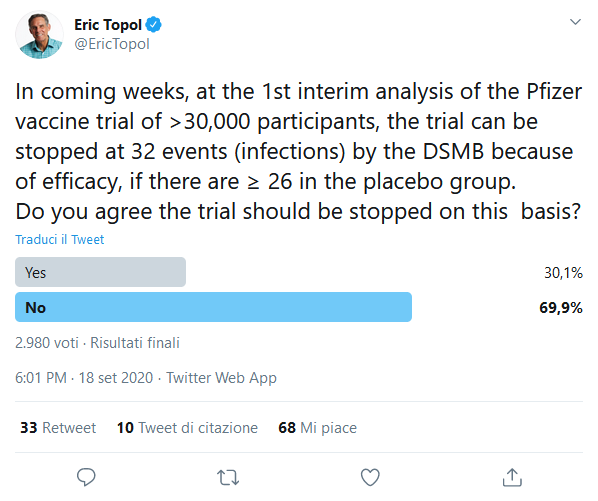
Il Dr. Eric Topol, esperto di studi clinici presso la Scripps Research di San Diego, ha fatto a Moderna «grandi complimenti» per aver condiviso il suo protocollo, ma ha espresso delusione per il fatto che Moderna includa nella ricerca persone con forme relativamente lievi di COVID-19. Ha detto che si avrebbero prove più convincenti dell'efficacia del vaccino se l'azienda tenesse conto solo di casi da moderati a gravi. Secondo Topol il protocollo di Moderna prevede la possibilità di interrompere la sperimentazione in anticipo dopo un numero relativamente limitato di casi, cosa che a suo parere potrebbe portare ad una sovrastima dell'efficacia del vaccino e a successivi problemi di sicurezza se il vaccino venisse somministrato a milioni di persone.
Topol è stato più critico nei confronti del protocollo di Pfizer perché include casi ancora meno gravi di quelli di Moderna e perché fornisce maggiori possibilità di interrompere la sperimentazione in anticipo, basandosi su un numero molto limitato di casi. «Prendetevi il tempo che serve, anche settimane extra» ha detto il dottor Topol. «Nessuna scorciatoia. Nessuno se ne pentirà. Mi sono occupato di studi clinici per decenni. Non so se ce n'è mai stato uno più importante di questo. Vorrei che fosse fatto bene e che non venisse fermato anzitempo».
Negli studi di Moderna e di Pfizer, metà dei partecipanti assume il vaccino e l'altra metà un placebo, senza che né i volontari né i medici sappiano chi assume cosa. Sono necessarie due dosi, a quattro settimane di distanza l'una dall'altra per Moderna e tre settimane per Pfizer. I partecipanti vengono poi monitorati per vedere se sviluppano sintomi di COVID-19 e risultano positivi al test per il virus. Vengono anche monitorati gli effetti collaterali dei vaccini. Che il vaccino sia efficace o meno, la salute dei partecipanti sarà monitorata per due anni dopo la seconda iniezione.
Considerata la spinta a portare sul mercato un vaccino il più presto possibile, molti ricercatori esterni alle sperimentazioni stanno analizzando i dettagli sulla potenziale interruzione anticipata delle sperimentazioni. Se il vaccino fosse estremamente efficace, potrebbero interrompere la sperimentazione perché non sarebbe etico continuare a dare ad alcuni partecipanti un placebo. Il comitato di sicurezza potrebbe anche sospendere la sperimentazione se vi fossero prove di un danno arrecato ai partecipanti, come è avvenuto recentemente nello studio sul vaccino di AstraZeneca.
Il comitato, chiamato DSMB (data-safety monitoring board), effettuerà la sua prima analisi dei dati di efficacia di Moderna una volta diagnosticati 53 casi di COVID-19. La prima analisi di Pfizer sarà effettuata dopo 32 casi. Il comitato potrebbe raccomandare l'interruzione della sperimentazione di Moderna dopo 53 casi, se risultasse efficace al 74%. Nel caso di Pfizer, l'efficacia dovrebbe essere di circa il 77%.
La Food and Drug Administration ha comunicato che qualsiasi vaccino contro il coronavirus deve avere efficacia di almeno il 50%.
Il tempo necessario per lo sviluppo del processo dipende dalla traiettoria della pandemia e dalla probabilità che i partecipanti siano esposti al virus.
L'amministratore delegato di Moderna, Stéphane Bancel, ha detto che l'azienda riferirà pubblicamente i risultati della prima analisi intermedia, e di quella successiva. Pfizer ha detto che condividerà le informazioni sulle analisi solo se si deciderà di interrompere il processo, o perché è molto efficace o perché non sembra funzionare.
Sia Moderna che Pfizer hanno previsto di produrre milioni di dosi di vaccino all'inizio del 2021. Ma la popolazione mondiale è di sette miliardi di persone, e tutti avrebbero bisogno di due dosi.
«Nella prima metà del prossimo anno, prevedo che il mondo avrà a disposizione un’offerta limitata di vaccino, il che significa che non ci sarà abbastanza vaccino per vaccinare tutti», ha detto Bancel di Moderna.
Fonti: Grady D, Thomas K. Moderna and Pfizer Reveal Secret Blueprints for Coronavirus Vaccine Trials. The New York Times. Sept 17, 2020
Account Twitter del Dr. Eric Topol