Linee guida sulla sepsi 2021 - parte 3
All’inizio di ottobre del 2021 sono state aggiornate e pubblicate le linee guida per screening e trattamento precoce della sepsi. Disponibile su esanum una sintesi in italiano delle novità più importanti.
Linee guida internazionali per la gestione della sepsi e dello shock settico 2021
La sepsi è “una disfunzione degli organi pericolosa per la vita causata da una risposta deregolata dell’ospite contro un’infezione”, estremamente diffusa e gravata da elevata mortalità e morbilità. L’intervento precoce contro la sepsi è dimostrato essere efficace nel migliorare l’outcome. All’inizio di ottobre del 2021 sono state pubblicate ed aggiornate le linee guida per screening e trattamento precoce. Queste linee guida rappresentano il risultato del lavoro di un gruppo di 60 esperti e di un’indagine condotta tra 800 medici intensivisti provenienti da più di 30 Paesi.
4 - Gestione emodinamica
Gestione dei fluidi
La fluidoterapia è cruciale nella gestione dei pazienti con sepsi/shock settico.
Per quanto la questione di quale sia il fluido ideale nella sepsi rimanga ancora dibattuta, le Linee guida 2021 pongono alcuni importanti punti chiave, soprattutto sancendo la definitiva superiorità dei colloidi rispetto ai cristalloidi.
I cristalloidi sono, quindi, i fluidi raccomandati. Nell’ambito dei cristalloidi, vi sono ben noti rischi potenziali correlati all’uso della soluzione salina (acidosi ipercloremica, vasocostrizione renale, aumento della secrezione di citochine) per cui il panel suggerisce l’utilizzo di soluzioni bilanciate, ma per questa edizione delle linee guida il livello di evidenza è ancora limitato (raccomandazione debole, livello di evidenza basso) dall’eterogeneità degli studi sinora pubblicati e dalla loro non specificità per quanto riguarda il paziente settico. Sono in corso attualmente specifici e ampi RCTs (BaSICS e PLUS) che in futuro permetteranno un update di tale raccomandazione.
L’albumina ha ancora un ruolo dibattuto. Sebbene lo studio principale e specifico sinora pubblicato (ALBIOS, 2014) non abbia dimostrato l’efficacia della supplementazione di albumina in termini di mortalità, né in termini di più precoce svezzamento da ventilatore o da amine, con l'utilizzo di albumina si è visto un aumento della pressione arteriosa, delle pressioni di riempimento e un minore introito fluidico complessivo. Ne consegue che le linee guida attuali suggeriscano l’utilizzo di questo emocomponente per quei pazienti già trattati con grandi volumi di cristalloidi (raccomandazione debole, evidenza moderata). La scarsità dei dati attuali non permette di identificare dei cut-off di somministrazione fluidica al di sopra dei quali è indicata l’aggiunta di albumina.
Gli starches permangono controindicati, con un livello di raccomandazione forte e un livello di evidenza elevato: nessuno studio ha messo in discussione quanto già stabilito dalle precedenti linee guida del 2016.
Anche le gelatine (colloidi sintetici) vengono sconsigliate, seppure con un grado di evidenza e una forza della raccomandazione minore rispetto agli starches per via della più scarsa qualità dei dati presenti in letteratura. I rischi potenziali principali del loro impiego riguardano lo sviluppo di anafilassi e le alterazioni della coagulazione, documentati in alcuni studi non specifici per il contesto della sepsi.
Agenti vasoattivi
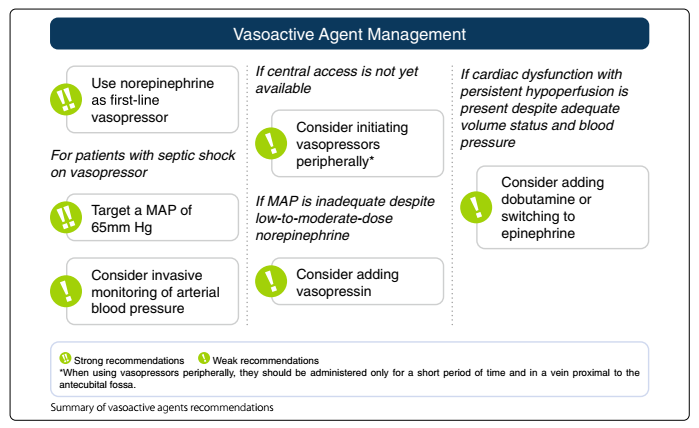
La noradrenalina è il farmaco di prima scelta nello shock settico rispetto a tutti gli altri vasopressori.
È un potente alfa-1 e beta-1 agonista, provocando vasocostrizione e aumento della MAP senza significative modifiche nella frequenza cardiaca.
In particolare, la noradrenalina è risultata superiore alla dopamina in una metanalisi (Avni T Lados A, PlosOne 2015) in termini di riduzione della mortalità e del rischio di aritmia e non differente dall’epinefrina, ma con minori rischi (Myburgh, Intensive Care Med, 2008). Pertanto l’utilizzo della dopamina e dell’epinefrina, gravate da maggiori rischi soprattutto aritmici, è da limitarsi a contesti di scarsa disponibilità di risorse o laddove la noradrenalina non sia immediatamente disponibile.
La noradrenalina va iniziata appena riconosciuto lo shock settico non responsivo ad adeguata idratazione, con target di MAP 65 mmHg.
La vasopressina è un pepetide endogeno prodotto nell’ipotalamo e rilasciato dall’ipofisi; il suo meccanismo di vasocostrizione è multifattoriale, prevalentemente per legame diretto ai recettori V1 del muscolo liscio vascolare. Studi (Holmes, Chest 2001, Landry, Circulation 1997) hanno dimostrato come nello shock settico la vasopressina è elevata nelle prime fasi, ma poi ritorna al basale dopo 24-48 ore. Questo fenomeno, chiamato “deficit relativo di vasopressina”, ha ancora un significato clinico non noto.
La vasopressina di sintesi, rispetto agli altri vasopressori, non ha un dosaggio titolato sulla risposta ma viene somministrata al dosaggio di 0,03 unità/min (1,8 IU/H) nello shock settico. Dosaggi superiori a 0,06 unità/min conducono a ischemia cardiaca, splancnica e digitale.
L’impiego della vasopressina nella sepsi è stato studiato in particolare da due RCTs: lo studio VANISH (Gordon AC, Jama 2016) ha comparato l’utilizzo di vasopressina in alternativa alla noradrenalina nello shock settico (non differenze in termini di mortalità, ma con la vasopressina riduzione del rischio di RRT), mentre lo studio VASST (Russell JA NEJM 2008) è stato disegnato per valutarne l’efficiacia nello shock settico in associazione alla noradrenalina: seppure non dimostrando un aumento di mortalità, entrambi gli studi dimostrano un effetto di riduzione dell’impiego di catecolamine, riducendo quindi il carico adrenergico correlato alle catecolamine tradizionali. Per la stesura delle attuali Linee Guida 2021 sono stati valutati 10 RCTs, concludendo per la superiorità dell’associazione di noradrenalina e vasopressina rispetto alla sola noradrenalina. Non vi è forte indicazione su quale sia il cut-off di noradrenalina a partire dal quale è indicato l’avvio di vasopressina. Il panel suggerisce un dosaggio compreso tra 0,25 e 0,5 mcg/kg/min.
Qualora anche l’associazione di noradrenalina e vasopressina risultasse non sufficiente, seppure con un livello di evidenza basso il panel suggerisce l’aggiunta di epinefrina, seppure consci del fatto che il target recettoriale è il medesimo e che quindi il recettore alfa-1 potrebbe essere già saturo e deregolato. Tale inotropo può avere invece un ruolo nei pazienti in cui alla sepsi si associ disfunzione miocardica.
Sono stati effettuati studi sperimentali sul ruolo potenziale di angiotensina III e selepressina. Sostanzialmente si tratta di sostanze ancora troppo poco sperimentate in questo ambito per attribuire indicazioni al loro utilizzo. L’uso della terlipressina è sconsigliato.
Inotropi
La disfunzione miocardica indotta dalla sepsi è uno dei principali fattori che contribuiscono all’instabilità emodinamica e il suo manifestarsi è associato a peggiore outcome.
La terapia con farmaci inotropi è suggerita in presenza di persistente ipoperfusione anche a fronte di adeguato riempimento e di adeguata MAP, e in pazienti con disfunzione miocardica dimostrata da ridotta portata cardiaca e aumento delle pressioni di riempimento.
I farmaci più utilizzati a tale scopo sono la dobutamina e l’epinefrina, di cui non è dimostrata la superiorità dell’una rispetto all’altra nel contesto della sepsi.
Non vi sono studi che dimostrano la superiorità della dobutamina in aggiunta alla noradrenalina rispetto alla sola noradrenalina e una metanalisi degli studi presenti è difficile per la presenza di numerosi fattori confondenti (es.: non chiaro timing dell’inizio dell’associazione), per cui il panel si limita a suggerire l’impiego di inotropi nelle situazioni selezionate e specifiche esposte sopra con grado di evidenza debole.
Quale sia l’inotropo scelto, deve essere sospeso se non c'è miglioramento o se vi è comparsa di effetti collaterali.
Il levosimendan non ha dimostrato, in una metanalisi, una riduzione della mortalità versus nessun agente inotropo; lo studio LeoPARDS (Gordon AC, NEJM, 2016) ha dimosrato non solo l’assenza di benefici ma la maggiore incidenza di effetti collaterali (tachiaritmia, allungamento del tempo di intubazione) e una metanalisi versus dobutamina non ha dimostrato la sua superiorità. Inoltre è costoso e non disponibile in tutti i contesti. Per tali motivi il suo uso è sconsigliato (evidenza bassa).
Monitoraggio e accessi vascolari
La pressione arteriosa è un parametro fondamentale. Il monitoraggio non invasivo discontinuo è per sua natura impreciso e inaccurato, soprattutto negli stati di shock. L’inserimento di una linea arteriosa è consigliato non appena è tecnicamente possibile farlo. Il profilo di sicurezza di tale manovra è molto elevato. Il basso grado della raccomandazione è dovuto alla scarsità di studi versus monitoraggio non invasivo e alla necessità di universalità di tali linee guida anche in contesti di Paesi emergenti.
Come già scritto nel capitolo dei vasopressori, in presenza di ipotensione, dopo adeguata somministrazione di fluidi, è importante avviare la somministrazione di noradrenalina.
Solitamente, tale farmaco viene somministrato in un CVC nel timore di complicanze locali, che tuttavia negli studi (pochi) sinora pubblicati non sono significative. Inoltre, la necessità di reperire un accesso centrale, manovra non appannaggio di tutto il personale che gestisce pazienti settici, non solo in contesti di povertà, rischia di far slittare il momento in cui viene somministrata la terapia, esitando in un più difficile controllo della MAP (Beck, Crit Care, 2014; Black LP, J AM Coll Emerg Physicians Open, 2020).
Per tali motivi le attuali linee guida suggeriscono di iniziare la noradrenalina in un vaso periferico purchè vicino alla fossa antecubitale, se il CVC non è immediatamente disponibile, ma di non ritardare il posizionamento dello stesso.
Gestione dei fluidi: liberale o restrittiva?
La domanda è ancora priva di risposta. Non vi è sufficiente evidenza per esprimere una raccomandazione riguardo l’utilizzo liberale o restrittivo dei fluidi nelle prime 24 ore di rianimazione di pazienti che hanno ancora segni di ipoperfusione (non di ipotensione!) dopo il primo bolo fluidico. Il panel rimanda al guidizio clinico e suggerisce la somministrazione di fluidi solo in presenza di segni di ipoperfusione.
L’assenza di evidenza persiste (quasi paradossalmente, ndr) nonostante di recente siano stati disegnati e conclusi numerosi studi. I quattro più grandi (Rivers, ProCESS, ARISE e ProMISe) prevedevano la somministrazione di grandi quantità di fluidi (7-8 l, Rivers addirittura 13 l) riportando una ridotta mortalità. Tuttavia, le grandi quantità di fluidi possono danneggiare l’integrità vascolare (il glicocalice endoteliale) e condurre a disfunzione d’organo (Alphonsus CS, Anaesthesia, 2014) e recenti dati africani (Andrews B JAMA 2017), seppure gravati dal bias di una popolazione e un contesto diverso da quello occidentale, suggeriscono la conclusione opposta.
Attualmente sono in corso due grandi studi (CLOVERS e CLASSIC) i cui risultati aiuteranno a rispondere alla domanda.
Le Linee guida internazionali per la gestione della sepsi e dello shock settico 2021 sono disponibili qui: Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021.
La European Society of Intensive Care Medicine e la Society of Critical Care Medicine hanno pubblicato delle tabelle riassuntive: SSC concise reccomendation tables
La traduzione in italiano non è al momento disponibile.
Su esanum puoi trovare un breve riassunto delle novità più importanti:NOTA SULLA TRADUZIONE: per rendere scorrevole il testo in italiano e contemporaneamente esprimere la forza delle raccomandazioni, la traduzione è stata fatta come segue:
- High recommendation/we recommend = è raccomandato
- Weak recommendation/we suggest = è suggerito
- Weak recommendation/we suggest against = è sconsigliato
- Strong recommendation against/We do not recommend = è controindicato/vi è una raccomandazione contro
Questa sintesi in italiano non è da considerarsi a valenza di linea guida ufficiale. Per la pratica clinica vi invitiamo a prendere visione del testo originale.
Fonte: Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, Machado FR, Mcintyre L, Ostermann M, Prescott HC, Schorr C, Simpson S, Wiersinga WJ, Alshamsi F, Angus DC, Arabi Y, Azevedo L, Beale R, Beilman G, Belley-Cote E, Burry L, Cecconi M, Centofanti J, Coz Yataco A, De Waele J, Dellinger RP, Doi K, Du B, Estenssoro E, Ferrer R, Gomersall C, Hodgson C, Møller MH, Iwashyna T, Jacob S, Kleinpell R, Klompas M, Koh Y, Kumar A, Kwizera A, Lobo S, Masur H, McGloughlin S, Mehta S, Mehta Y, Mer M, Nunnally M, Oczkowski S, Osborn T, Papathanassoglou E, Perner A, Puskarich M, Roberts J, Schweickert W, Seckel M, Sevransky J, Sprung CL, Welte T, Zimmerman J, Levy M. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021 Nov;47(11):1181-1247. doi: 10.1007/s00134-021-06506-y. Epub 2021 Oct 2. PMID: 34599691; PMCID: PMC8486643.