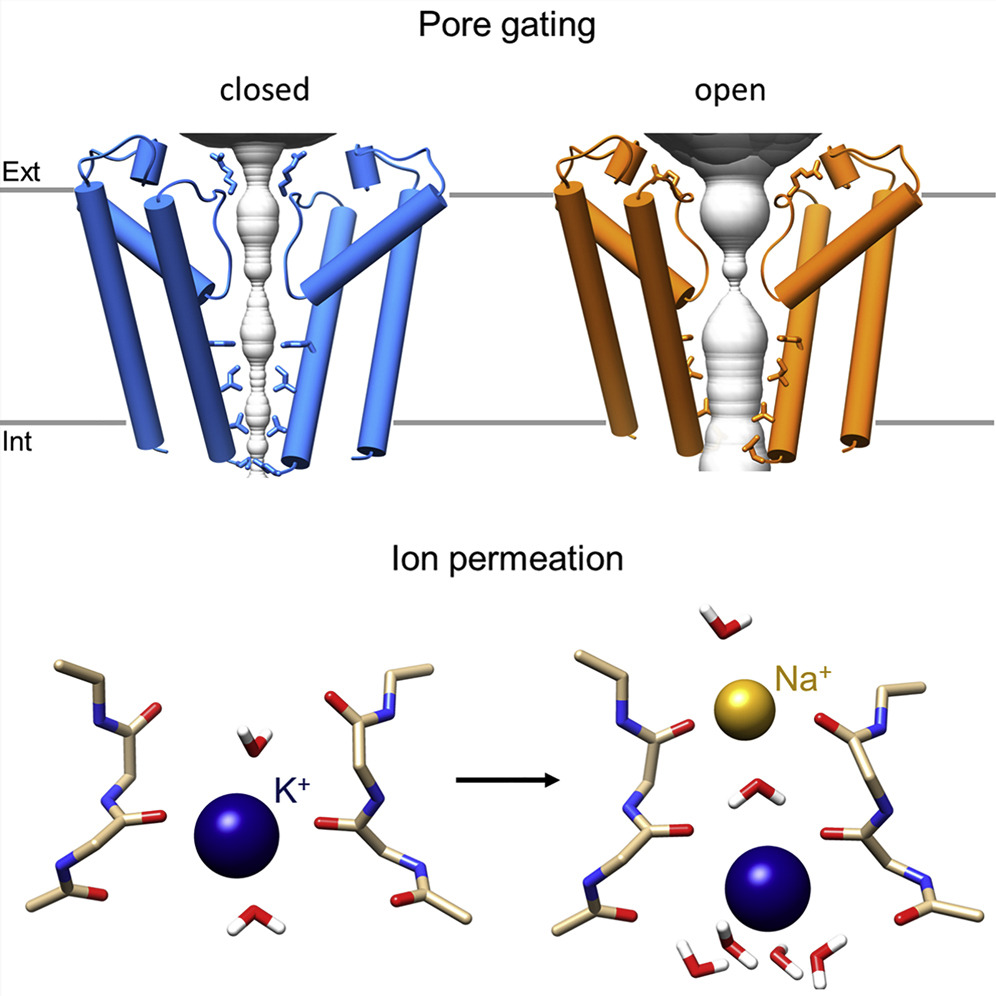
Struttura dei canali HCN4
Su "Molecular Cell", uno studio recente descrive a livello atomico il meccanismo di funzionamento del canale HCN4, la proteina "pacemaker", che regola l'attività ritmica del cuore.
Risolta la struttura del canale del pacemaker HCN4
Su "Molecular Cell", uno studio recente descrive a livello atomico il meccanismo di funzionamento del canale HCN4, la proteina "pacemaker", che regola l'attività ritmica del cuore.
Il battito cardiaco è in prima istanza un processo elettrico ed è per sua natura automatico, non dipende cioè da impulsi esterni. A garantirne l’automaticità contribuiscono i canali HCN, proteine che generano delle piccole correnti elettriche che collegano la fine di un battito al successivo.
Lo studio internazionale coordinato dall’Università Statale di Milano, e pubblicato su Molecula Cell, mostra, per la prima volta, una proteina HCN in conformazione aperta, e permette di spiegare come le cariche elettriche passino attraverso di essa. “Il risultato ha un forte impatto in ambito farmacologico in quanto fornisce i dettagli atomici dell'azione dell'Ivabradina, l'unico inibitore dei canali HCN in commercio, ponendo le basi per lo sviluppo di nuovi farmaci” commenta Andrea Saponaro, primo autore dello studio.
“L’ivabradina è un farmaco caratterizzato in precedenza dai professori Bucchi e Di Francesco, del laboratorio Pacelab - dipartimento di Bioscienze, e impiegato con successo nel trattamento dell’angina” spiega Anna Moroni, docente di Fisiologia vegetale, coordinatrice del lavoro - ma essendo poco specifico per la proteina HCN4, può portare ad effetti indesiderati che potranno essere affrontati e risolti grazie alle conoscenze di questo studio".
Il lavoro nasce dalla proficua collaborazione tra il gruppo di Biofisica dei canali ionici dell’Università Statale di Milano (Moroni-Saponaro) e la Columbia University, presso la quale Anna Moroni e Andrea Saponaro hanno svolto ricerca al fine di consolidare e sviluppare le loro competenze sulla biologia strutturale delle proteine di membrana, ponendo l’Università Statale di Milano tra i centri d’avanguardia nel campo.
Lo studio si è avvalso della recente acquisizione da parte della Statale e CRC-Centro di Ricerca Pediatrica Romeo ed Enrica Invernizzi del sistema di microscopia crioelettronica di singola particella, presente presso il dipartimento di Bioscienze dell’Ateneo. Voluto e guidato da Martino Bolognesi, docente di Biochimica, il laboratorio di Microscopia crioelettronica della Statale di Milano è il primo ad aver portato in Italia tale metodica pionieristica. Hanno partecipato al lavoro Paolo Swuec, ora allo Human Technopole, e Antonio Chaves-Sanjuan, del dipartimento di Bioscienze.
Oltre alla biologia strutturale d’avanguardia, un ruolo determinate nella comprensione dei meccanismi di permeazione degli ioni attraverso il poro dei canali HCN, così come del blocco da Ivabradina, è stato apportato da analisi “in-silico”, quali la simulazione di dinamica molecolare, coordinate da Gerhard Thiel e Kay Hamacher, professori della Università politecnica di Darmstadt.
Il lavoro di ricerca si inserisce nel progetto coordinato da Andrea Saponaro, finanziato da Fondazione Cariplo, volto all'identificazione di caratteristiche isoforma-specifiche dei vari componenti della famiglia dei canali HCN, nel progetto finanziato dalla Fondazione Telethon, coordinato da Anna Moroni, sulla comprensione e cura di malattie genetiche legate ai canali HCN e nel progetto finanziato dalla Fondazione Leducq a Dario Di Francesco, professore emerito di fisiologia dell’ateneo, volto alla comprensione dei meccanismi molecolari alla base della regolazione dell’attività del canale HCN4.
Fonti: Comunicato Stampa. Risolta la struttura del canale del pacemaker HCN4. Università degli Studi di Milano. 24/06/2021
Saponaro A, Bauer D, Giese MH, Swuec P, Porro A, Gasparri F, Sharifzadeh AS, Chaves-Sanjuan A, Alberio L, Parisi G, Cerutti G, Clarke OB, Hamacher K, Colecraft HM, Mancia F, Hendrickson WA, Siegelbaum SA, DiFrancesco D, Bolognesi M, Thiel G, Santoro B, Moroni A. Gating movements and ion permeation in HCN4 pacemaker channels. Mol Cell. 2021 Jun 18:S1097-2765(21)00446-9. doi: 10.1016/j.molcel.2021.05.033. Epub ahead of print. PMID: 34166608.