Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, Boriani G, Cardinale D, Cordoba R, Cosyns B, Cutter DJ, de Azambuja E, de Boer RA, Dent SF, Farmakis D, Gevaert SA, Gorog DA, Herrmann J, Lenihan D, Moslehi J, Moura B, Salinger SS, Stephens R, Suter TM, Szmit S, Tamargo J, Thavendiranathan P, Tocchetti CG, van der Meer P, van der Pal HJH; ESC Scientific Document Group. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022 Aug 26:ehac244. doi: 10.1093/eurheartj/ehac244. Epub ahead of print. PMID: 36017568.
Salim Hayek. 2022 ESC Guidelines on Cardio-Oncology: Key Points. American College of Cardiology. Aug 29, 2022
Linee guida ESC 2022 Cardio-Oncologia
Sintesi in italiano delle "Linee guida sulla Cardio-Oncologia 2022" sviluppate dalla European Society of Cardiology.
Perché i cardiologi dovrebbero occuparsi delle terapie antitumorali?
Si prevede che entro il 2030 si aggiungeranno al carico globale oltre 20 milioni di nuovi casi di cancro. Le nuove terapie e/o le terapie combinate hanno migliorato la sopravvivenza al cancro, ma sono associate a complicazioni cardiovascolari, soprattutto negli anziani e nei soggetti con comorbidità cardiovascolari preesistenti. Attualmente la maggior parte dei cardiologi non conosce i trattamenti oncologici, non ha familiarità con i protocolli di dosaggio e le relative cardiotossicità. Questo può determinare la scelta di protocolli meno aggressivi e l'interruzione precoce di trattamenti importanti sia per le patologie oncologiche che per quelle cardiovascolari. È quindi necessaria una collaborazione multidisciplinare per migliorare le decisioni terapeutiche a beneficio dei pazienti oncologici. I cardiologi dovrebbero avere una conoscenza e una comprensione di base di alcuni dei farmaci chemioterapici comunemente utilizzati e di eventuali eventi avversi durante il trattamento, sulla base di studi clinici, rapporti della FDA e dati epidemiologici.
Che tipo di patologie gestiscono i cardio-oncologi?
I cardio-oncologi gestiscono una varietà di condizioni cardiovascolari ed eventi avversi associati al trattamento.
Le terapie oncologiche più comuni con cardiotossicità nota includono antracicline, farmaci anti-HER-2, radiazioni, inibitori della tirosin-chinasi, inibitori della tirosin-chinasi associati al VEGF, inibitori dell'aromatasi e anche trattamenti moderni, tra cui il trapianto di cellule staminali e le terapie CAR-T.
I pazienti vengono seguiti dal cardio-oncologo prima, durante e dopo le sessioni di trattamento. Gli eventi cardiovascolari comuni trattati includono ipertensione, dislipidemia, aritmie, insufficienza cardiaca, malattia coronarica e obesità.
Dopo il completamento della terapia antitumorale, l'attenzione si concentra sulla gestione dei fattori di rischio cardiovascolari e oncologici e sulla modifica dello stile di vita.
10 messaggi chiave delle Linee Guida ESC di Cardio-Oncologia
- Il documento fornisce definizioni standard per la cardiotossicità legata alle terapie oncologiche, indicazioni sulla valutazione del rischio di base e protocolli per la sorveglianza della cardiotossicità durante e dopo il trattamento oncologico, approfondendo le specificità delle singole classi di terapie oncologiche.
- Chi si occupa di cardio-oncologia deve avere un'ampia conoscenza della cardiologia, dell'oncologia e dell'ematologia. La comunicazione interdisciplinare è una componente cruciale della pratica clinica in questo ambito.
- Un principio guida della cardio-oncologia è quello di ridurre al minimo le interruzioni non necessarie della terapia oncologica, basando la decisione su discussioni multidisciplinari.
- L'ecocardiografia e i biomarcatori sono i principali metodi utilizzati per la valutazione e il monitoraggio della cardiotossicità.
- Una nuova raccomandazione sostiene la pratica di continuare a somministrare trastuzumab in pazienti asintomatici e con una lieve riduzione della frazione di eiezione ventricolare sinistra (49-50%) mentre si inizia una terapia cardioprotettiva.
- Una nuova raccomandazione sostiene la pratica di ridurre i farmaci cardioprotettivi nei pazienti sopravvissuti al cancro con funzionalità cardiaca conservata e a basso rischio di eventi cardiovascolari futuri.
- La stragrande maggioranza delle raccomandazioni hanno evidenza di livello C. Il documento lo riconosce in anticipo affermando che il campo della cardio-oncologia ha studi ed evidenze di alta qualità limitati su cui basare il processo decisionale.
- Il rischio di tossicità cardiovascolare è una variabile dinamica. Le linee guida sono strutturate in modo da favorire un approccio personalizzato alla definizione del rischio basale di tossicità cardiovascolare. Si raccomanda una valutazione del rischio cardiovascolare di base per tutti i pazienti con tumore che devono ricevere una terapia antitumorale potenzialmente cardiotossica. Questo consente all'équipe oncologica di considerare il rischio cardiovascolare durante le scelte terapeutiche, di educare i pazienti in merito al loro rischio cardiovascolare e di personalizzare la sorveglianza cardiovascolare e la strategia di follow-up.
- Tra le raccomandazioni di classe I (da fare obbligatoriamente), solo cinque raccomandazioni hanno un'evidenza di livello A.
- Uso di eparina a basso peso molecolare (LMWH) per la profilassi del tromboembolismo venoso (TEV) in pazienti con mieloma multiplo e fattori di rischio di TEV.
- Monitoraggio del QTc al basale, a 14 giorni e a 28 giorni nei pazienti che ricevono ribociclib.
- Trattamento del TEV con apixaban, edoxaban o rivaroxaban in pazienti con TEV e cancro.
- Trattamento del TEV con LMWH in pazienti con cancro e conta piastrinica >50.000 µL.
- Risonanza magnetica cardiaca per la valutazione dei pazienti con sospetta amiloidosi cardiaca AL.
- Ci sono cinque raccomandazioni di classe III (da non fare).
- Evitare i farmaci che allungano il QT nei pazienti con cancro e cardiomiopatia di Takotsubo.
- Evitare l'aspirina nei pazienti con cancro e trombocitopenia se le piastrine sono <10.000 µL.
- Evitare il clopidogrel nei pazienti oncologici con piastrine <30.000 µL; evitare prasugrel e ticagrelor se le piastrine sono <50.000 µL.
- Aspirina o LMWH non sono raccomandate per la prevenzione primaria dell'ictus o del tromboembolismo sistemico nei pazienti con cancro e fibrillazione atriale.
- Diltiazem e verapamil non sono raccomandati per il trattamento dell'ipertensione nei pazienti con cancro a causa di interazioni farmaco-farmaco.
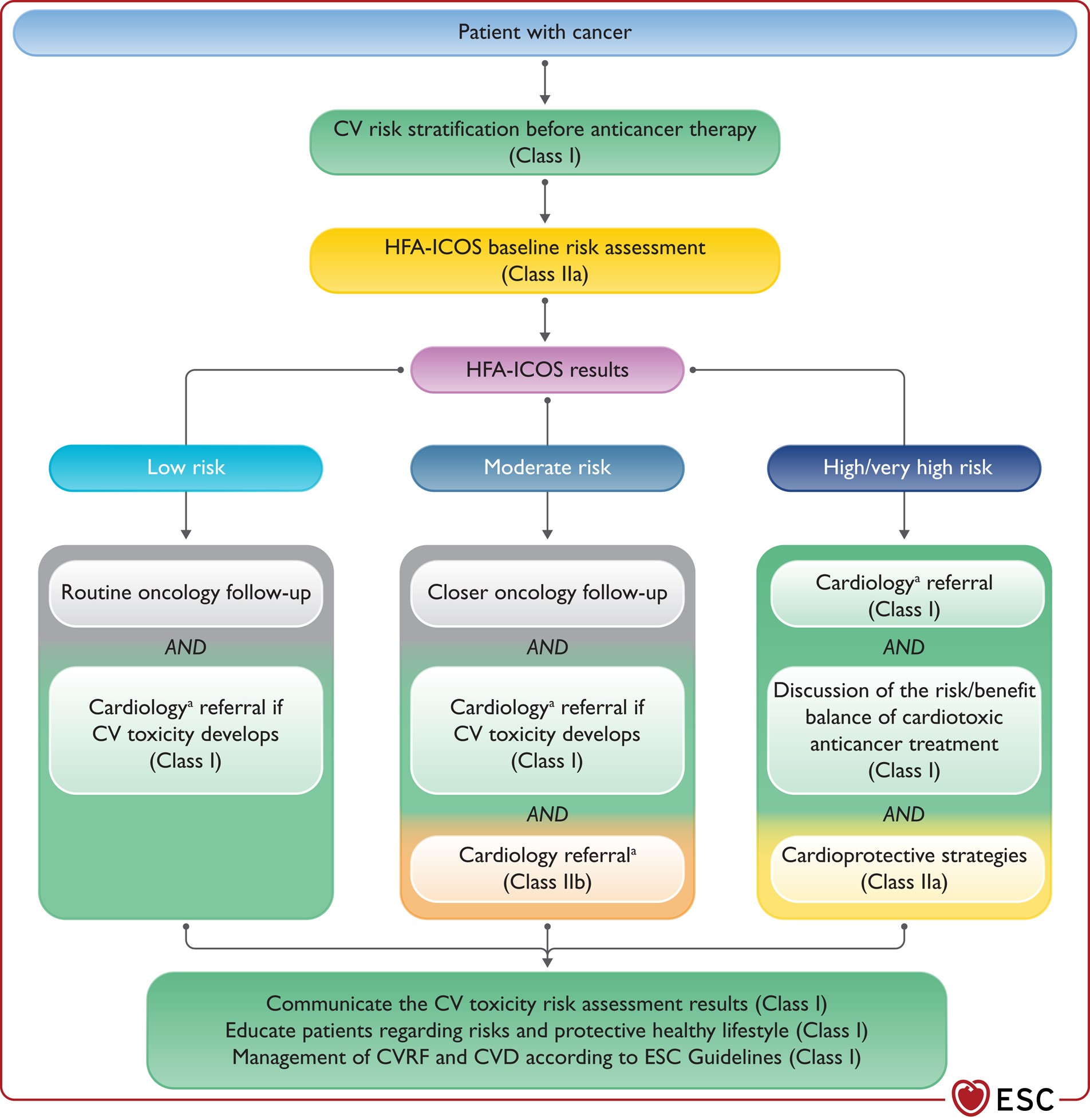
Stratificazione del rischio di tossicità cardiovascolare prima della terapia antitumorale
Il momento ottimale per prendere in considerazione le strategie di prevenzione della malattia cardiovascolare (CVD) nei pazienti oncologici è quello della diagnosi e prima dell'inizio del trattamento. Ciò consente all'équipe oncologica di considerare il rischio cardiovascolare (CV) durante le scelte terapeutiche, di educare i pazienti in merito al loro rischio CV, di personalizzare le strategie di sorveglianza e follow-up CV e di indirizzare in modo appropriato i pazienti ad alto rischio ai servizi di cardio-oncologia. Queste strategie sono necessarie per ridurre il rischio di CVD e migliorare l'aderenza a trattamenti oncologici efficaci e la sopravvivenza complessiva.
Le strategie di prevenzione cardiovascolare richiedono un approccio personalizzato. La valutazione del rischio è un compito impegnativo ed è fondamentale che i medici adottino un approccio sistematico senza ritardare il trattamento oncologico.
Approccio generale alla classificazione del rischio di tossicità cardiovascolare
- La stratificazione del rischio di tossicità CV prima di iniziare una terapia antitumorale potenzialmente cardiotossica è raccomandata in tutti i pazienti con cancro (classe I, B).
- Si raccomanda di comunicare i risultati della valutazione del rischio di tossicità CV al paziente e agli altri operatori sanitari coinvolti (classe I, C).
- Si raccomanda che i pazienti classificati a basso rischio di tossicità CV procedano senza indugio alla terapia antitumorale (classe I, C).
- Il referto cardiologico è raccomandato nei pazienti ad alto e altissimo rischio prima della terapia antitumorale (classe I, C).
- Si raccomanda di discutere il rapporto rischio/beneficio del trattamento antitumorale cardiotossico nei pazienti ad alto e altissimo rischio in un approccio multidisciplinare prima di iniziare il trattamento (classe I, C).
- Si raccomanda un consulto cardiologico per i pazienti con cancro e CVD preesistente o risultati anormali alla valutazione del rischio di tossicità CV al basale che necessitano di una terapia antitumorale potenzialmente cardiotossica (classe I, C).
Elettrocardiogramma (ECG)
- Un ECG è raccomandato in tutti i pazienti che iniziano una terapia antitumorale come parte della valutazione del rischio CV di base (classe I, C).
- Nei pazienti con un ECG basale anormale, si raccomanda di rivolgersi a un cardiologo (classe I, C)
Biomarker
- La misurazione basale di peptide natriuretico (NP) e/o di troponina cardiaca (cTn) è raccomandata in tutti i pazienti con tumore a rischio di disfunzione cardiaca legata alla terapia oncologica (CTRCD, cancer therapy-related cardiac dysfunction), se questi biomarcatori verranno misurati durante il trattamento per individuare la CTRCD (classe I, C).
Imaging
- L'ecocardiografia è raccomandata come modalità di prima linea per la valutazione della funzione cardiaca nei pazienti con cancro (classe I, C).
- L'ecocardiografia 3D è raccomandata come modalità ecocardiografica preferita per misurare la LVEF (frazione di eiezione ventricolare sinistra) (classe I, B).
- Il GLS (strain longitudinale globale) è raccomandato in tutti i pazienti con tumore sottoposti a ecocardiografia, se disponibile (classe I, C).
- La TTE (ecocardiografia transtoracica) completa al basale è raccomandata in tutti i pazienti con cancro ad alto e altissimo rischio di tossicità CV prima di iniziare la terapia antitumorale (classe I, C).
Riassumendo
- La stratificazione del rischio di cardiotossicità deve essere completata utilizzando il modello dell'Associazione per lo Scompenso Cardiaco dell'ESC in collaborazione con la Società Internazionale di Cardio-Oncologia (HFA-ICOS) prima dell'inizio della terapia oncologica.
- I pazienti devono essere informati dei risultati della stratificazione del rischio.
- Ai pazienti ritenuti a basso rischio si raccomanda di iniziare la terapia oncologica senza indugio.
- I pazienti considerati a rischio moderato devono essere indirizzati a un cardiologo.
- I pazienti con un'anamnesi di malattia cardiovascolare (CVD) o considerati ad alto o altissimo rischio devono essere indirizzati a un cardiologo.
- Si raccomanda un approccio multidisciplinare prima dell'inizio della terapia oncologica.
Approccio generale alla cardio-oncologia dopo la valutazione del rischio di tossicità cardiovascolare HFA-ICOS
fonte: Eur Heart J, ehac244, https://doi.org/10.1093/eurheartj/ehac244
Prevenzione e monitoraggio delle complicanze cardiovascolari durante la terapia oncologica
Il rischio di CTR-CVT (tossicità cardiovascolare legata alla terapia del cancro) può variare in base al tipo e allo stadio del tumore, ai farmaci antitumorali, alle dosi e alle comorbidità sottostanti. Alcune combinazioni di terapie (farmaco-farmaco o farmaco-radiazioni) possono avere un effetto tossico sinergico sul cuore, eventualmente in base alla tempistica di queste terapie (sequenziali o concomitanti) e alle comorbidità precedenti.
CVD e cancro hanno in comune fattori di rischio modificabili e non modificabili. Il primo passo è ottimizzare lo stile di vita per minimizzare i fattori di rischio cardiovascolare (CVRF): smettere di fumare, limitare il consumo di alcol a un massimo di 100 g a settimana e mantenere un'adeguata attività fisica. La prescrizione di esercizio fisico sembra essere un trattamento promettente per contrastare gli effetti collaterali del trattamento antitumorale e diversi tipi di allenamento possono essere prescritti durante la terapia oncologica in base alle caratteristiche individuali del paziente. Uno stile di vita sano riduce i rischi di cancro, CVD e transizione da un cancro diagnosticato a una successiva CVD.
Raccomandazioni per la prevenzione primaria della tossicità cardiovascolare legata alla terapia del cancro
- La gestione dei fattori di rischio cardiovascolare secondo le linee guida ESC 2021 sulla prevenzione della CVD nella pratica clinica è raccomandata prima, durante e dopo la terapia oncologica (classe I, C).
- Il dexrazoxano deve essere preso in considerazione nei pazienti adulti con cancro a rischio di tossicità CV elevato e molto elevato quando è indicata la chemioterapia con antracicline (classe IIa, B).
- Le antracicline liposomiali devono essere prese in considerazione nei pazienti adulti con cancro ad alto e altissimo rischio di tossicità CV quando è indicata la chemioterapia con antracicline (classe IIa, B).
- Inibitori dell’enzima di conversione dell’angiotensina (ACE) o inibitori del recettore AT1 dell’angiotensina II (ARB) e i beta-bloccanti raccomandati per lo scompenso cardiaco devono essere presi in considerazione per la prevenzione primaria nei pazienti ad alto e altissimo rischio che assumono antracicline e/o terapie anti-HER2 (classe IIa, B).
- Inibitori dell’enzima di conversione dell’angiotensina (ACE) o inibitori del recettore AT1 dell’angiotensina II (ARB) e i beta-bloccanti raccomandati per lo scompenso cardiaco devono essere presi in considerazione per la prevenzione primaria nei pazienti ad alto e altissimo rischio che assumono terapie oncologiche mirate che possono causare scompenso cardiaco (classe IIa, C).
- Le statine dovrebbero essere prese in considerazione per la prevenzione primaria nei pazienti adulti con cancro ad alto e altissimo rischio di tossicità CV (classe IIa, B).
Strategie di prevenzione secondaria
La prevenzione secondaria si riferisce agli interventi nei pazienti con CVD preesistente, compresa la CTR-CVT (Cancer therapy-related cardiovascular toxicity) pregressa e la nuova CTR-CVT emergente durante la terapia oncologica. La CVD e le comorbidità dovrebbero ricevere la terapia ottimale prima e durante la terapia oncologica. Nei pazienti che assumono terapie oncologiche cardiotossiche si raccomandano regolari valutazioni cliniche, esami fisici e indagini CV (compresi ECG a 12 derivazioni, TTE e biomarcatori cardiaci), con una frequenza di sorveglianza guidata dal rischio basale e dall'emergere di nuove CTR-CVT.
Protocolli di monitoraggio della tossicità cardiovascolare legata alla terapia del cancro
ANTRACICLINE
Le antracicline sono tra i più potenti farmaci antineoplastici mai sviluppati ma il loro utilizzo continua ad essere limitato dagli effetti cardiotossici che possono causare disfunzione ventricolare sinistra e scompenso cardiaco. Il rischio di tossicità aumenta con dosi cumulative crescenti di tali medicinali ed è maggiore negli individui con anamnesi di cardiomiopatia, irradiazione mediastinica o patologia cardiaca preesistente. È possibile peraltro che il danno si manifesti a distanza di anni dal trattamento.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante la chemioterapia con antracicline e nei primi 12 mesi dopo la terapia
TTE
- L'ecocardiografia di base è raccomandata in tutti i pazienti con cancro prima della chemioterapia con antracicline (classe I, B).
- In tutti gli adulti sottoposti a chemioterapia con antracicline, si raccomanda un ecocardiogramma entro 12 mesi dal termine del trattamento (classe I, B).
- Nei pazienti ad alto e altissimo rischio, l'ecocardiografia è raccomandata ogni due cicli ed entro 3 mesi dal termine del trattamento (classe I, C).
Biomarcatori
- La misurazione basale di NP e cTn è raccomandata nei pazienti ad alto e altissimo rischio prima della chemioterapia con antracicline (classe I, B).
- Il monitoraggio di cTn e NP prima di ogni ciclo di chemioterapia con antracicline e a 3 e 12 mesi dal termine della terapia è raccomandato nei pazienti ad alto e altissimo rischio (classe I, B).
TERAPIE MIRATE AL RECETTORE 2 DEL FATTORE DI CRESCITA EPITELIALE (HER2)
Le terapie mirate a HER2 sono una parte fondamentale del trattamento di pazienti con tumore al seno invasivo HER2+. È riconosciuto che le terapie anti-HER2 possono portare a disfunzione ventricolare sinistra (LVD) fino al 15-20% dei pazienti e a scompenso cardiaco se la sorveglianza non viene attuata correttamente nei pazienti ad alto e altissimo rischio.
Raccomandazioni per la valutazione e il monitoraggio del rischio al basale durante le terapie mirate all'HER2 e nei primi 12 mesi dopo la terapia. primi 12 mesi dopo la terapia
TTE
- L'ecocardiografia basale è raccomandata prima delle terapie mirate all'HER2 in tutti i pazienti (classe I, B).
- Nei pazienti sottoposti a terapie neoadiuvanti o adiuvanti mirate all'HER2, l'ecocardiografia è raccomandata ogni 3 mesi ed entro 12 mesi dal termine del trattamento (classe I, B).
- Nella malattia metastatica HER2+, l'ecocardiografia è raccomandata ogni 3 mesi durante il primo anno; se la paziente rimane asintomatica senza tossicità CV, la sorveglianza può essere ridotta a ogni 6 mesi durante il trattamento futuro (classe I, C).
Biomarcatori
- La misurazione di NP e di cTn al basale è raccomandata nelle pazienti ad alto e altissimo rischio prima delle terapie mirate anti-HER2 (classe I, C).
FLUOROPIRIMIDINE (FP)
Le fluoropirimidine, come il 5-FU (5 fluorouracile) e il suo farmaco orale capecitabina, sono utilizzate principalmente per i tumori maligni gastrointestinali e per il cancro al seno in fase avanzata. Le CTR-CVT più comuni sono l'angina pectoris, anomalie ECG legate all'ischemia, ipertensione, sindrome di Takotsubo (TTS) e IMA (anche in pazienti con arterie coronarie normali).
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante la terapia con fluoropirimidine
- Prima di iniziare la terapia con fluoropirimidine, si raccomanda di effettuare una valutazione del rischio CV al basale che comprenda la misurazione della pressione arteriosa, l'ECG, il profilo lipidico, la misurazione dell'HbA1c e i punteggi SCORE2/SCORE2-OP o equivalenti (classe I, C).
- Prima di iniziare la somministrazione di fluoropirimidine si raccomanda un ecocardiogramma al basale nei pazienti con una storia di CVD sintomatica (classe I, C).
INIBITORI VEGF (FATTORE DI CRESCITA DELL’ENDOTELIO VASCOLARE)
L'attivazione aberrante delle chinasi svolge un ruolo critico sia nello sviluppo di numerosi tipi di cancro sia nell'omeostasi CV e metabolica. I VEGFi sono utilizzati per il trattamento di numerosi tipi di cancro, tra cui il carcinoma renale, tiroideo ed epatocellulare.
Tuttavia, il loro uso è associato a una vasta gamma di complicazioni CV, tra cui ipertensione, scompenso cardiaco, prolungamento del QTc ed eventi vascolari acuti.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante l'assunzione di inibitori del VEGF
Monitoraggio della pressione arteriosa (PA)
- Nei pazienti trattati con VEGFi, bevacizumab o ramucirumab si raccomanda la misurazione della pressione arteriosa a ogni visita clinica (classe I, C).
- Si raccomanda il monitoraggio domiciliare quotidiano della PA per i pazienti trattati con VEGFi durante il primo ciclo, dopo ogni aumento della dose di VEGFi e successivamente ogni 2-3 settimane (classe I, C).
Monitoraggio ECG
- Nei pazienti trattati con VEGFi a rischio moderato o elevato di prolungamento del QTc, si raccomanda un monitoraggio del QTc mensile nei primi 3 mesi e successivamente ogni 3-6 mesi (classe I, C).
Ecocardiografia
- L'ecocardiografia basale è raccomandata nei pazienti ad alto e altissimo rischio trattati con VEGFi o bevacizumab (classe I, C).
INIBITORI DELLA TIROSIN-CHINASI BCR-ABL
La leucemia mieloide cronica (LMC) deriva dall'attivazione aberrante della chinasi BRC-ABL1 a causa di una traslocazione cromosomica. I TKI a piccole molecole che hanno come bersaglio BCR-ABL, tra cui imatinib, bosutinib, dasatinib, nilotinib e ponatinib, si sono dimostrati efficaci nel trattamento della CML. Le tossicità associate a questi TKI sono uniche e dovute agli effetti "fuori bersaglio" di ciascun farmaco.
Raccomandazioni per la valutazione del rischio di base e per il monitoraggio durante la terapia con inibitori della tirosin-chinasi BCR-ABL di seconda e terza generazione
- La valutazione del rischio CV al basale è raccomandata nei pazienti che necessitano di un TKI BCR-ABL di seconda o terza generazione (classe I, C).
- Nei pazienti trattati con nilotinib o ponatinib, la valutazione del rischio CV è raccomandata ogni 3 mesi durante il primo anno e successivamente ogni 6-12 mesi (classe I, C).
- L'ecocardiografia basale è raccomandata nei pazienti che devono assumere dasatinib (classe I, C).
INIBITORI DELLA TIROSIN-CHINASI DI BRUTON (BTK)
Gli inibitori BTK sono sempre più utilizzati per il trattamento dei linfomi maligni. Ibrutinib, un inibitore orale irreversibile di BTK, si è dimostrato altamente efficace nella leucemia linfatica cronica e nei tumori maligni a cellule B ad essa correlati, tra cui linfoma mantellare, macroglobulinemia di Waldenström e linfomi della zona marginale. Questi disturbi vengono solitamente diagnosticati in pazienti anziani, nei quali al momento della diagnosi coesistono frequenti comorbilità che aumentano il rischio di CTR-CVT.
Raccomandazioni per la valutazione del rischio al basale e per il monitoraggio durante la terapia con inibitori della BTK
Monitoraggio e gestione della PA
- Nei pazienti trattati con inibitori di BTK si raccomanda la misurazione della pressione arteriosa a ogni visita clinica (classe I, B).
Ecocardiografia
- L'ecocardiografia al basale è raccomandata nei pazienti ad alto rischio che devono assumere inibitori di BTK (classe I, C).
- La TTE è raccomandata in tutti i pazienti che sviluppano fibrillazione atriale (FA) durante la terapia con inibitori di BTK (classe I, C).
Fibrillazione atriale
- Si raccomanda uno screening opportunistico per la fibrillazione atriale (FA) mediante la rilevazione del polso o la striscia ECG a ogni visita clinica durante la terapia con inibitori di BTK (classe I, C).
TERAPIE PER IL MIELOMA MULTIPLO (MM)
Esistono numerose classi di farmaci approvate per il trattamento del mieloma multiplo, che vengono usate in diverse combinazioni. Queste includono farmaci immunomodulatori (IMiD), desametasone, inibitori del proteasoma (PI) e anticorpi monoclonali (ad esempio daratumumab). I PI, tra cui bortezomib, carfilzomib e ixazomib, sono diventati un pilastro della terapia per il mieloma multiplo di nuova diagnosi e per la malattia recidivata. Diversi studi di grandi dimensioni che hanno utilizzato la terapia combinata per il mieloma multiplo hanno dimostrato un aumento del rischio di eventi CV avversi gravi.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante le terapie per il mieloma multiplo
Monitoraggio della PA
- Nei pazienti trattati con PI si raccomanda la misurazione della pressione arteriosa a ogni visita clinica (classe I, C).
Biomarcatori
- La misurazione di NP è raccomandata prima della somministrazione di PI nei pazienti ad alto e altissimo rischio (classe I, C).
- La misurazione di NP e di cTn è raccomandata al basale e ogni 3-6 mesi nei pazienti con AL-CA, amiloidosi da catene leggere (classe I, B).
TTE
- L'ecocardiografia al basale, compresa la valutazione dell'AL-CA, è raccomandata in tutti i pazienti con mieloma multiplo per i quali è prevista la somministrazione di PI (classe I, C).
Profilassi del tromboembolismo venoso (TEV)
- Dosi terapeutiche di LMWH (eparine a basso peso molecolare) sono raccomandate nei pazienti con MM con precedente TEV (classe I, B).
- Dosi profilattiche di LMWH sono raccomandate nei pazienti con MM con fattori di rischio correlati al TEV (escluso il TEV pregresso) almeno durante i primi 6 mesi di terapia (classe I, A).
- L'aspirina dovrebbe essere considerata un'alternativa alla LMWH nei pazienti con MM senza fattori di rischio o con un fattore di rischio legato al TEV (escluso il TEV pregresso) almeno nei primi 6 mesi di terapia (classe IIa, B).
- Basse dosi di apixaban o rivaroxaban possono essere considerate un'alternativa alla LMWH o all'aspirina in pazienti con MM con fattori di rischio correlati al TEV (escluso il TEV pregresso) almeno durante i primi 6 mesi di terapia (classe IIb, C).
INIBITORI DEL FIBROSARCOMA RAPIDAMENTE ACCELERATO (RAF) E INIBITORI DELLA PROTEINA CHINASI MITOGENO-ATTIVATA (MEK)
Gli inibitori RAF - vemurafenib, dabrafenib ed encorafenib - sono approvati per il trattamento del melanoma metastatico con mutazione BRAF V600. Anche gli inibitori della proteina chinasi mitogeno-attivata (MEK) - trametinib, cobimetinib, binimetinib e selumetinib - hanno mostrato una significativa attività clinica nei pazienti affetti da melanoma con una mutazione BRAF V600 e sono ora largamente utilizzati in combinazione con gli inibitori RAF. I principali effetti CV da considerare sono l'ipertensione, l’embolia polmonare) e la CTRCD, che sono associati a tutte le combinazioni di inibitori di RAF e MEK, e il prolungamento del QTc, associato esclusivamente alla co-somministrazione di cobimetinib e vemurafenib. Il trattamento con inibitori RAF da soli o in combinazione con un inibitore MEK è associato a un aumento del rischio di infarto del miocardio e FA.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante la terapia combinata di inibitori RAF e MEK
- Si raccomanda il monitoraggio della pressione arteriosa a ogni visita clinica e il monitoraggio ambulatoriale settimanale durante i primi 3 mesi di trattamento e successivamente mensile (classe I, C).
- Nei pazienti trattati con cobimetinib/vemurafenib, si raccomanda un ECG a 2 e 4 settimane dall'inizio del trattamento e successivamente ogni 3 mesi (classe I, C).
- L'ecocardiografia basale è raccomandata in tutti i pazienti ad alto e altissimo rischio per i quali è prevista la somministrazione di inibitori combinati di RAF e MEK (classe I, C).
INIBITORI DEL CHECKPOINT IMMUNITARIO (ICI)
Le immunoterapie che sfruttano il sistema immunitario per distruggere le cellule tumorali sono disponibili in diverse forme, ma le più utilizzate sono gli ICI. Gli ICI includono anticorpi monoclonali, linfociti T CTLA-4 (ipilimumab, tremelimumab), PD-1 (nivolumab, cemiplimab, pembrolizumab) e PD-L1 (atezolizumab, avelumab, durvalumab). L'ICI può anche innescare un'iperattivazione delle cellule T contro i tessuti non cancerosi, con conseguenti eventi avversi immuno-correlati. Gli effetti collaterali CV immuno-correlati possono portare a complicazioni CV pericolose per la vita, quali miocardite fulminante, miopericardite, disfunzione cardiaca, aritmie o infarto del mio cardio, che spesso portano all'interruzione dell'ICI.
Raccomandazioni per la valutazione del rischio al basale e il monitoraggio durante l'immunoterapia
- Le misurazioni di ECG, NP e cTn sono raccomandate in tutti i pazienti prima di iniziare la terapia con ICI (classe I, B).
- L'ecocardiografia di base è raccomandata nei pazienti ad alto rischio prima di iniziare la terapia ICI (classe I, B).
- La valutazione CV è raccomandata ogni 6-12 mesi nei pazienti ad alto rischio che richiedono un trattamento ICI a lungo termine (>12 mesi) (classe I, C).
TERAPIA DI BLOCCO ANDROGENICO (ADT)
La terapia ADT viene prescritta nel 40% degli uomini con cancro alla prostata come terapia neoadiuvante e/o adiuvante alla radioterapia o in caso di recidiva dopo l'intervento chirurgico per il cancro alla prostata.
Gli agonisti dell'ormone di rilascio delle gonadotropine (GnRH) sono gli ADT più frequentemente prescritti. Tuttavia, gli agonisti del GnRH sono associati a un aumento del rischio CV e della mortalità, in particolare nei pazienti con cancro alla prostata di età superiore ai 60 anni.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante la terapia ADT per il cancro alla prostata
- La valutazione del rischio CV di base e la stima del rischio CVD fatale e non fatale a 10 anni con SCORE2 o SCORE2-OP sono raccomandate nei pazienti trattati con ADT senza CVD preesistente (classe I, B).
- Si raccomandano ECG basali e seriali nei pazienti a rischio di prolungamento del QTc durante la terapia ADT (classe I, B).
- Durante l'ADT si raccomanda una valutazione annuale del rischio CV (classe I, B).
TERAPIE ENDOCRINE PER IL CANCRO AL SENO
La terapia endocrina è un trattamento comune, dato che il 65-70% di tutte le pazienti con cancro al seno precoce e metastatico sviluppa una malattia positiva ai recettori ormonali. I modulatori selettivi del recettore estrogenico (tamoxifene, toremifene) o gli inibitori dell'aromatasi AI (letrozolo, anastrozolo, o exemestane) sono raccomandati nel cancro al seno precoce (EBC) in base allo stato menopausale, alle comorbidità e al rischio di ricaduta della malattia.
L'uso di AI in combinazione con gli inibitori delle chinasi ciclina-dipendente (CDK4/6) è raccomandato come terapia di prima o seconda linea nelle pazienti con BC metastatico HR+/HER2-.
Raccomandazioni per la valutazione del rischio basale e il monitoraggio durante la terapia endocrina per il cancro al seno
- La valutazione del rischio CV al basale e la stima del rischio CVD fatale e non fatale a 10 anni con SCORE2 o SCORE2-OP sono raccomandate in pazienti con BC che ricevono terapie endocrine senza preesistente CVD (classe I, C).
- Si raccomanda una valutazione annuale del rischio CV durante la terapia endocrina nelle pazienti con BC con elevato rischio a 10 anni di eventi CV (fatali e non fatali) secondo SCORE2/SCORE2-OP (classe I, C).
INIBITORI DELLE CHINASI CICLINA-DIPENDENTE 4/6 (CDK4/6)
L'uso di CDK 4/6 (palbociclib, ribociclib e abemaciclib) in combinazione con la terapia endocrina è approvato per il trattamento di pazienti con cancro al seno metastatico HR+/HER2-. Questa combinazione ha portato a un miglioramento della sopravvivenza libera da progressione e, in alcuni studi, della sopravvivenza globale. Gli inibitori delle CDK 4/6 hanno dimostrato un potenziale di prolungamento del QT, in particolare con ribociclib.
Raccomandazioni per la valutazione del rischio al basale e per il monitoraggio durante la terapia con inibitori della CDK4/6
- Si raccomanda il monitoraggio del QTc al basale e a 14 e 28 giorni in tutte le pazienti con cancro che ricevono ribociclib (classe I, A).
- Il monitoraggio del QTc è raccomandato nelle pazienti trattate con ribociclib con qualsiasi aumento di dose (classe I, B).
INIBITORI DELLA CHINASI DEL LINFOMA ANAPLASTICO (ALK) E INIBITORI DEL GENE CODIFICANTE PER IL RECETTORE DELL'EPIDERMAL GROWTH FACTOR (EGFR)-TKI
I pazienti affetti da tumore trattati con inibitori ALK possono sviluppare eventi avversi a livello CV, tra cui bradicardia sinusale, blocco AV, prolungamento del QTc, ipertensione, iperglicemia e dislipidemia. Raramente sono stati descritti sindrome coronarica acuta e scompenso cardiaco con crizotinib.
Osimertinib è un inibitore orale irreversibile del recettore del fattore di crescita epidermico approvato per i pazienti con carcinoma polmonare non a piccole cellule che esprimono mutazioni EGFR. Dati recenti hanno dimostrato che osimertinib è associato a un aumento del rischio di prolungamento del QTc, FA, TEV, LVD e scompenso cardiaco.
Raccomandazioni per la valutazione del rischio al basale e il monitoraggio durante l'assunzione di inibitori ALK e EGFR
- La valutazione del rischio CV al basale è raccomandata nei pazienti prima degli inibitori di ALK e degli inibitori di EGFR (classe I, C).
- L'ecocardiografia basale è raccomandata in tutti i pazienti con cancro prima di iniziare osimertinib (classe I, B).
TERAPIE CAR-T (CHIMERIC ANTIGEN RECEPTOR T CELL THERAPIES) E TIL (TUMOR-INFILTRATING LYMPHOCYTES)
La terapia CAR-T è utilizzata per il trattamento della leucemia linfocitica acuta e dei linfomi a cellule B aggressivi. Sebbene l'incidenza riportata sia variabile, è sempre più riconosciuta l'associazione tra terapia CAR-T e CTR-CVT, tra cui LVD, scompenso cardiaco, aritmie cardiache, versamento pericardico, sindrome di Takotsubo (TTS) e arresto cardiaco. La maggior parte delle tossicità CV descritte si è dimostrata associata alla comparsa della sindrome da rilascio di citochine (CRS).
La terapia cellulare adottiva con TIL è emersa come una efficace opzione terapeutica per il melanoma metastatico non resecabile in stadio III/IV. Con le TIL, la tossicità CV sembra essere correlata alla tossicità diretta sul miocardio e sui vasi sanguigni.
Raccomandazioni per la valutazione e il monitoraggio del rischio al basale in pazienti che assumono terapie CAR-T e TIL
- Si raccomandano ECG, NP e cTn al basale in tutti i pazienti con cancro prima di iniziare le terapie CAR-T e TIL (classe I, C).
- Prima di iniziare le terapie CAR-T e TIL, si raccomanda un'ecocardiografia al basale nei pazienti con CVD preesistente (classe I, C).
- La misurazione di NP, cTn e l'ecocardiografia sono raccomandate nei pazienti che sviluppano CRS di grado ≥ 2 secondo la scala ASTCT (classe I, C).
RADIOTERAPIA (RT)
La radioterapia aumenta il rischio di sviluppare successivamente CVD e arteriopatia periferica (PAD). È in corso un dibattito sulla dose di radiazioni più sicura, su quali siano le sottostrutture cardiache più sensibili alle lesioni indotte dalla RT e sulle strategie più appropriate per ridurre al minimo la CVD correlata alla RT. Il cuore è considerato un "organo a rischio" radiosensibile durante la radioterapia e l'esposizione alle radiazioni deve essere mantenuta al livello più basso ragionevolmente raggiungibile, poiché non esiste una dose "sicura".
Raccomandazioni per la valutazione del rischio basale dei pazienti prima della radioterapia
- Si raccomanda la valutazione del rischio CV di base e la stima del rischio CVD fatale e non fatale a 10 anni con SCORE2 o SCORE2-OP (classe I, B).
TRAPIANTO DI CELLULE STAMINALI EMATOPOIETICHE (HSCT)
Il trapianto di cellule staminali ematopoietiche (HSCT) costituisce un'opzione terapeutica potenzialmente curativa per molte neoplasie ematologiche. I miglioramenti nelle tecniche di trapianto di cellule staminali emopoietiche e nelle strategie di supporto hanno ridotto notevolmente la mortalità correlata al trattamento. C'è una crescente tossicità CV correlata all'HSCT e i sopravvissuti all'HSCT costituiscono una popolazione ad alto rischio CV futuro.
Raccomandazioni per la valutazione del rischio basale nei pazienti sottoposti a trapianto di cellule staminali ematopoietiche
- Nei pazienti sottoposti a trapianto di cellule staminali ematopoietiche si raccomanda una valutazione del rischio CV basale e seriale (a 3 e 12 mesi, poi annualmente) che comprenda la misurazione della pressione arteriosa, l'ECG, la misurazione dei lipidi e l'HbA1c (classe I, C).
- L'ecocardiografia è raccomandata in tutti i pazienti prima del trapianto di cellule staminali (classe I, C).
Diagnosi e gestione della tossicità cardiovascolare acuta e subacuta nei pazienti sottoposti a trattamento antitumorale
Si raccomanda il lavoro in team multidisciplinare per discutere dei pazienti con cancro che sviluppano complicanze CV acute durante il loro trattamento oncologico. Si raccomanda il rinvio a un servizio specializzato di cardio-oncologia per i pazienti oncologici che presentano una nuova CTR-CVT durante e dopo il trattamento oncologico.
La prevenzione e la gestione della CVD nei pazienti affetti da tumore dovrebbero generalmente seguire le linee guida ESC pubblicate per le CVD specifiche. Le linee guida forniscono indicazioni sulla gestione delle CTR-CVT che si verificano durante il trattamento del cancro, e mette in evidenza i casi in cui la gestione differisce per i pazienti con cancro rispetto a quelli senza cancro. La decisione di iniziare un trattamento CV (farmaci, dispositivi) deve comprendere la considerazione di una serie di fattori, tra cui il carico di sintomi del cancro e cardiovascolari la prognosi del cancro, le esigenze di trattamento del cancro, comprese le opzioni alternative, possibili reazioni avverse ai farmaci, interazioni farmaco-farmaco, e le preferenze del paziente. Le linee guida comprendono un elenco completo di interazioni farmaco-farmaco.
Gestione della disfunzione cardiaca correlata al trattamento del cancro con antracicline
CTRCD sintomatica indotta da chemioterapia con antracicline
- La terapia dello scompenso cardiaco è raccomandata per i pazienti che sviluppano una CTRCD sintomatica durante la chemioterapia con antracicline (classe I, B).
- L'interruzione della chemioterapia con antracicline è raccomandata nei pazienti che sviluppano una CTRCD sintomatica grave (classe I, C).
- L'interruzione temporanea della chemioterapia con antracicline è raccomandata nei pazienti che sviluppano una CTRCD moderata sintomatica e si raccomanda un approccio multidisciplinare per la decisione di ricominciare (classe I, C).
- Nei pazienti che sviluppano una CTRCD sintomatica lieve si raccomanda un approccio multidisciplinare riguardo all'interruzione o alla continuazione della chemioterapia con antracicline (classe I, C).
CTRCD asintomatica indotta da chemioterapia con antracicline
- Si raccomanda l'interruzione temporanea della chemioterapia con antracicline e l'inizio della terapia dello scompenso cardiaco nei pazienti che sviluppano una CTRCD asintomatica moderata o grave (classe I, C).
- In tutti i pazienti con CTRCD asintomatica moderata o grave si raccomanda un approccio multidisciplinare per decidere quando riprendere la terapia (classe I, C).
- La continuazione della chemioterapia con antracicline è raccomandata nei pazienti asintomatici con LVEF ≥ 50% e che hanno sviluppato un calo significativo della GLS o un innalzamento della troponina o di NP (classe I, C).
Gestione della disfunzione cardiaca correlata al trattamento del cancro con anti-HER2
CTRCD sintomatica indotta da terapia anti-HER2
- La terapia dello scompenso cardiaco è raccomandata per i pazienti che sviluppano una CTRCD sintomatica da moderata a grave con LVEF <50% durante il trattamento mirato con HER2 (classe I, B).
- L'interruzione temporanea del trattamento con HER2-target è raccomandata nei pazienti che sviluppano una CTRCD sintomatica moderata o grave e la decisione di ricominciare deve essere basata su un approccio multidisciplinare dopo il miglioramento della funzione LV e la risoluzione dei sintomi (classe I, C).
- Nei pazienti che sviluppano una CTRCD sintomatica lieve, la terapia dello scompenso cardiaco e un approccio multidisciplinare sulla decisione di continuare o interrompere la terapia mirata a HER2 sono raccomandati. interrompere la terapia mirata a HER2 (classe I, C).
CTRCD asintomatica indotta da terapia anti-HER2
- Nei pazienti che sviluppano una CTRCD asintomatica grave si raccomanda l'interruzione temporanea della terapia con HER2-target e l'inizio di una terapia per scompenso cardiaco (classe I, C).
- Nei pazienti con CTRCD asintomatica grave si raccomanda un approccio multidisciplinare alla decisione di riprendere la terapia con HER2 (classe I, C).
- Nei pazienti che sviluppano una CTRCD asintomatica lieve (LVEF ≥ 50%) si raccomanda la continuazione della terapia mirata a HER2 con monitoraggio cardiaco più frequente (classe I, C).
- ACE-I/ARB e beta-bloccanti sono raccomandati nei pazienti che sviluppano una CTRCD moderata asintomatica (LVEF 40-49%) durante il trattamento con HER2 (classe I, C).
Gestione della miocardite associata a inibitori del checkpoint immunitario
- Per la diagnosi di miocardite associata a ICI si raccomandano cTn, ECG e imaging CV (classe I, B).
- Nei pazienti con sospetta miocardite associata a ICI, si raccomanda l'interruzione temporanea del trattamento con ICI fino alla conferma o alla smentita della diagnosi. confermata o smentita (classe I, C).
- L'interruzione del trattamento con ICI è raccomandata nei pazienti con miocardite confermata associata a ICI (classe I, C).
- Per tutti i pazienti con miocardite sintomatica associata a ICI si raccomanda un monitoraggio ECG continuo per valutare la presenza di nuovi blocchi AV e tachiaritmie durante la fase acuta (classe I, C).
- Si raccomanda di somministrare precocemente corticosteroidi ad alte dosi nei pazienti con cancro e miocardite associata a ICI confermata (classe I, C).
- La continuazione dei corticosteroidi ad alte dosi è raccomandata per il trattamento della miocardite associata a ICI fino alla risoluzione dei sintomi, della disfunzione sistolica LV, delle anomalie di conduzione e della riduzione significativa di cTn (classe I, C).
- Per i pazienti con miocardite fulminante associata a ICI si raccomanda il ricovero in terapia intensiva, il trattamento con metilprednisolone per via endovenosa e il trattamento CV ottimale, compreso il supporto meccanico, quando indicato (classe I, C).
- Si raccomanda una discussione multidisciplinare prima di riavviare il trattamento con ICI in pazienti selezionati con precedente miocardite non complicata associata a ICI (classe I, C).
Gestione della sindrome di Takotsubo (TTS) nei pazienti con cancro
- Si raccomanda l'angiografia coronarica (invasiva o CCTA) per escludere una sindrome coronarica acuta (classe I, C).
- Si raccomanda la risonanza magnetica CMR per escludere miocardite e infarto miocardico (classe I, B).
- I farmaci che allungano il QT non sono raccomandati durante la fase acuta della TTS (classe III, C).
Gestione delle sindromi coronariche acute (ACS) nei pazienti in trattamento antitumorale
- Si raccomanda una strategia invasiva nei pazienti con cancro che presentano STEMI o NSTE-ACS (sindrome coronarica acuta senza sopraslivellamento persistente del tratto ST) ad alto rischio con aspettativa di vita ≥6 mesi (classe I, B).
- Si raccomanda l'interruzione temporanea della terapia antitumorale nei pazienti in cui si sospetta che la terapia antitumorale sia una causa scatenante (classe I, C).
- Nei pazienti con cancro, trombocitopenia e ACS, l'aspirina non è raccomandata se le piastrine sono pari a 10 000/µL (classe III, C).
- Nei pazienti con cancro, trombocitopenia e ACS, il clopidogrel non è raccomandato se le piastrine sono inferiori a 30 000/µL e il prasugrel o il ticagrelor non sono raccomandati se le piastrine sono inferiori a 50 000/µL (classe III, C)
Gestione delle sindromi coronariche croniche nei pazienti in trattamento antitumorale
- Nei pazienti affetti da cancro con sindrome coronarica cronica, dopo la rivascolarizzazione, si raccomanda una durata personalizzata della DAPT (duplice terapia antiaggregante) in base al rischio trombotico/ischemico e di sanguinamento, al tipo e allo stadio del cancro e al trattamento oncologico in corso (classe I, C).
Gestione della cardiopatia valvolare (VHD) nei pazienti in trattamento antitumorale
- Nei pazienti con cancro e preesistente VHD grave, si raccomanda la gestione secondo le Linee Guida ESC/EACTS 2021 per la gestione della VHD, tenendo conto della prognosi del cancro e delle preferenze del paziente (classe I, C).
- Nei pazienti con cancro che sviluppano una nuova VHD durante la terapia oncologica, si raccomanda la gestione secondo le Linee guida ESC/EACTS 2021 per la gestione della VHD, tenendo conto della prognosi del cancro e delle comorbidità del paziente (classe I, C).
Gestione della fibrillazione atriale nei pazienti sottoposti a trattamento antitumorale
- Si raccomanda l'anticoagulazione a lungo termine per la prevenzione di ictus/tromboembolismo sistemico nei pazienti affetti da cancro con fibrillazione atriale e un punteggio CHA2DS2-VASc ≥2 (uomini) o ≥3 (donne), secondo le Linee guida ESC 2020 per la diagnosi e la gestione della fibrillazione atriale (classe I, C).
- Si raccomanda una rivalutazione del rischio tromboembolico ed emorragico durante il follow-up dei pazienti affetti da cancro con fibrillazione atriale (classe I, C).
- La terapia antiaggregante o la LMWH profilattica non sono raccomandate per la prevenzione dell'ictus o del tromboembolismo sistemico nei pazienti con FA affetti da cancro (classe III, C).
Gestione del QTc lungo e delle aritmie ventricolari nei pazienti sottoposti a trattamento antitumorale
Come gestire il prolungamento del QTc nei pazienti con cancro
- Si raccomanda l'interruzione della terapia antitumorale che prolunga il QTc nei pazienti che sviluppano TdP (torsione di punta) o tachiaritmie ventricolari sostenute durante il trattamento (classe I, C).
- L'interruzione temporanea della terapia antitumorale con prolungamento del QTc è raccomandata nei pazienti che sviluppano un QTcF asintomatico ≥ 500 ms e un ECG deve essere ripetuto ogni 24 ore fino alla risoluzione del prolungamento del QTcF (classe I, C).
- Nei pazienti affetti da tumore che sviluppano un QTcF ≥ 500 ms si raccomanda l'immediata sospensione di qualsiasi farmaco e la correzione delle anomalie elettrolitiche e di altri fattori di rischio (classe I, C).
- Si raccomanda un monitoraggio ECG settimanale nei pazienti asintomatici con cancro con QTcF 480-500 ms che sono trattati con una terapia antitumorale che prolunga il QTc (classe I, C).
- Si raccomanda di eseguire un ECG a 12 derivazioni dopo qualsiasi aumento della dose di una terapia antitumorale che prolunga il QTc (classe I, C).
Riavvio della terapia antitumorale che prolunga il QTc
- Prima di riavviare i farmaci che prolungano il QTc nei pazienti che hanno sviluppato un prolungamento significativo del QTcF, si raccomanda una discussione multidisciplinare per discutere di trattamenti oncologici alternativi (classe I, C).
- Si raccomanda un monitoraggio ECG settimanale nelle prime 4-6 settimane e poi mensile nei pazienti affetti da tumore dopo il riavvio di una terapia antitumorale che prolunga il QTc (classe I, C).
Gestione dell'ipertensione arteriosa nei pazienti sottoposti a terapia antitumorale
Generale
- Si raccomanda un trattamento efficace dell'ipertensione arteriosa indotta dalla terapia antitumorale per prevenire l'interruzione del trattamento antitumorale e le complicanze CV (classe I, C).
- Durante la terapia antitumorale si raccomanda un obiettivo di pressione sistolica pari a 140 mmHg e diastolica pari a 90 mmHg (classe I, C).
- La valutazione del rischio oncologico e cardiovascolare è raccomandata se la PA sistolica è ≥180 mmHg o la PA diastolica ≥110 mmHg e qualsiasi terapia antitumorale associata all'ipertensione deve essere rinviata o temporaneamente sospesa fino a quando la pressione arteriosa non sia controllata a valori <160 mmHg (sistolica) e <100 mmHg (diastolica) (classe I, C).
Trattamento dell'ipertensione arteriosa indotta dalla terapia del cancro
- Gli ACE-I o gli ARB sono i farmaci antipertensivi di prima linea raccomandati per la gestione della PA nei pazienti con cancro (classe I, B).
- I calcio antagonisti (CCB) diidropiridinici sono raccomandati come farmaci antipertensivi di seconda linea per i pazienti affetti da cancro con PA non controllata (classe I, C).
- La terapia combinata con ACE-I o ARB e CCB diidropiridinici è raccomandata nei pazienti con cancro con pressione sistolica ≥ 160 mmHg e diastolica ≥ 100 mmHg (classe I, C).
- Diltiazem e verapamil non sono raccomandati per il trattamento dell'ipertensione arteriosa nei pazienti con cancro a causa delle loro interazioni farmaco-farmaco. interazioni farmaco-farmaco (classe III, C).
Gestione del tromboembolismo venoso (TEV) nei pazienti in trattamento antitumorale
- Apixaban, edoxaban o rivaroxaban sono raccomandati per il trattamento del TEV sintomatico o incidentale in pazienti con cancro senza controindicazioni (classe I, A).
- Le LMWH sono raccomandate per il trattamento del TEV sintomatico o incidentale in pazienti con cancro con conta piastrinica .50 000/µL (classe I, A).
- La durata dell'anticoagulazione nei pazienti affetti da cancro con TEV associato a catetere è raccomandata per un minimo di 3 mesi e per un periodo più lungo se il catetere rimane in situ (classe I, C).
Profilassi del tromboembolismo venoso durante il trattamento antitumorale
- Una profilassi prolungata con LMWH per 4 settimane dopo l'intervento è raccomandata per i pazienti con cancro sottoposti a trattamento addominale aperto o laparoscopico maggiore con basso rischio di sanguinamento e alto rischio di TEV (classe I, B).
- La profilassi con LMWH per la prevenzione primaria del TEV è indicata nei pazienti ospedalizzati con cancro o in quelli allettati o con mobilità ridotta, in assenza di emorragie o altre controindicazioni (classe I, B).
- Si raccomanda di discutere con il paziente i benefici e i danni relativi, la prognosi del cancro, il costo del farmaco e la durata del trattamento. prima di procedere all'anticoagulazione profilattica per la prevenzione primaria del TEV (classe I, C).
Gestione della malattia arteriosa periferica (PAD) durante il trattamento antitumorale
- Nei pazienti che sviluppano una nuova PAD sintomatica, si raccomanda un approccio multidisciplinare per decidere se continuare o interrompere la terapia antitumorale (classe I, C).
Gestione dell'ipertensione polmonare (PAH) durante il trattamento antitumorale
- Si raccomanda il cateterismo cardiaco destro e l'interruzione di dasatinib nei pazienti che sviluppano un aumento sintomatico o asintomatico del picco di TRV (flusso di rigurgito tricuspidale) > 3,4 m/s (classe I, C).
- Nei pazienti con PAH confermata indotta da dasatinib o con nuovo picco asintomatico di TRV > 3,4 m/s, si raccomanda un inibitore BCR-ABL alternativo dopo il recupero del picco TRV a < 2,8 m/s (classe I, C).
Gestione delle malattie del pericardio nei pazienti sottoposti a trattamento antitumorale
Generale
- La diagnosi e la gestione della pericardite acuta nei pazienti affetti da cancro si basano sulle Linee Guida ESC 2015 per la diagnosi e la gestione delle malattie del pericardio. È raccomandata ed è necessaria una discussione multidisciplinare prima di interrompere la terapia antitumorale (classe I, C).
Diagnosi e gestione della pericardite associata a ICI
- Per confermare la diagnosi, valutare le conseguenze emodinamiche della pericardite ed escludere una miocardite associata, si raccomanda l'imaging CV multimodale (ecocardiografia, CMR + TC), l'ECG e la misurazione dei biomarcatori cardiaci (classe I, C).
- Prednisolone e colchicina sono raccomandati per i pazienti con pericardite associata a ICI (classe I, C).
- Si raccomanda l'interruzione del trattamento con ICI nei pazienti con pericardite associata a ICI confermata e con versamento pericardico da moderato a grave (classe I, C).
- Si raccomanda una discussione multidisciplinare prima di riprendere il trattamento con ICI (classe I, C).
Valutazione del rischio cardiovascolare alla fine della terapia antitumorale
La valutazione del rischio CV alla fine della terapia antitumorale riguarda i primi 12 mesi dopo l'ultimo trattamento oncologico cardiotossico. Le linee guida prendono in considerazione i casi in cui la terapia oncologica cardiotossica è stata completata con successo e la prognosi a lungo termine è buona. Le raccomandazioni non sono indicate quando le terapie antitumorali sono state interrotte a causa della progressione del tumore e la prognosi è infausta, o quando sono indicate cure di fine vita.
I due obiettivi principali della valutazione del rischio di fine terapia oncologica sono identificare precocemente i pazienti con cardiotossicità correlata al trattamento oncologico e identificare i pazienti a rischio di complicazioni cardiovascolari tardive correlate al trattamento oncologico.
Sono bisognosi di sorveglianza nei 12 mesi successivi a una terapia oncologica potenzialmente cardiotossica:
- pazienti a rischio cardiotossico basale elevato o molto elevato, come determinato dal modello HFA-ICOS;
- pazienti che hanno assunto dosi maggiori di doxorubicina, radioterapia o una combinazione delle due;
- pazienti che hanno manifestato sintomi cardiotossici durante la terapia, tra cui disfunzione cardiaca correlata alla terapia oncologica, miocardite associata agli inibitori del checkpoint immunitario, aritmie, sindrome coronarica acura, ictus o malattia vascolare periferica;
- pazienti con nuovi sintomi CV o anomalie asintomatiche all'ecocardiografia e/o ai biomarcatori CV.
Le potenziali complicazioni a lungo termine legate ai trattamenti oncologici cardiotossici includono, ma non solo, disfunzione miocardica, scompenso cardiaco, malattia valvolare, malattia arteriosa periferica, ictus, complicazioni pericardiche, aritmie, sindrome metabolica e ipertensione polmonare.
- Si raccomanda di educare e sostenere i pazienti affetti da cancro a fare scelte di vita sane e appropriate (classe I, C).
- Si raccomanda di educare i pazienti con cancro a riconoscere i segni e i sintomi precoci di CVD (classe I, C).
- La valutazione del rischio cardiovascolare è raccomandata durante il primo anno dopo la terapia antitumorale e successivamente secondo le Linee Guida ESC 2021 sulla prevenzione delle CVD nella pratica clinica (classe I, B).
- Nei pazienti asintomatici ad alto rischio, l'ecocardiografia e i biomarcatori cardiaci sierici sono raccomandati a 3 e 12 mesi dal completamento della terapia oncologica (classe I, B).
- Si raccomanda di rivolgersi a un cardiologo per i pazienti con tumore che presentano nuovi sintomi cardiaci o nuove anomalie asintomatiche all'ecocardiografia e/o ai biomarcatori cardiaci alla valutazione di fine terapia (classe I, C).
- Nei pazienti che sviluppano una grave CTRCD durante la terapia oncologica si raccomanda la continuazione a lungo termine dei farmaci cardiaci (classe I, C).
- Si raccomanda il follow-up CV e l'ottimizzazione del trattamento nei pazienti che hanno sviluppato ipertensione mediata da TKI durante la terapia oncologica (classe I, C).
- Si raccomanda il follow-up CV e l'ottimizzazione del trattamento nei pazienti che hanno sviluppato tossicità vascolari durante la terapia oncologica (classe I, C).
- Si raccomanda il follow-up dell'ECG nei pazienti che hanno sviluppato un allungamento del QT o una LQTS (Sindrome del QT lungo) durante la terapia antitumorale (classe I, C).
Uno sguardo al futuro
I servizi di cardio-oncologia sono poco numerosi e la maggior parte dei pazienti viene esaminata in cliniche cardiologiche generali. Sono necessari investimenti strategici nelle reti di assistenza cardio-oncologica e nell'offerta di servizi di cardio-oncologia per soddisfare l'aumento della domanda clinica previsto nel prossimo futuro e per facilitare la ricerca, la formazione e le attività educative.
È urgente un programma di formazione medica di almeno un anno.
È necessaria la collaborazione tra operatori sanitari, ricercatori clinici e di base, autorità sanitarie, enti regolatori, gruppi di difesa e associazioni di pazienti per rispondere alle esigenze future.
Allo stato attuale esiste una significativa carenza di studi clinici per guidare il processo decisionale. Questo è complicato dal ritmo incalzante degli sviluppi dei nuovi trattamenti oncologici in un contesto di tossicità CV dinamica. Pertanto, sono necessari grandi numeri di pazienti e un follow-up più lungo per fornire una potenza statistica sufficiente e risposte definitive.
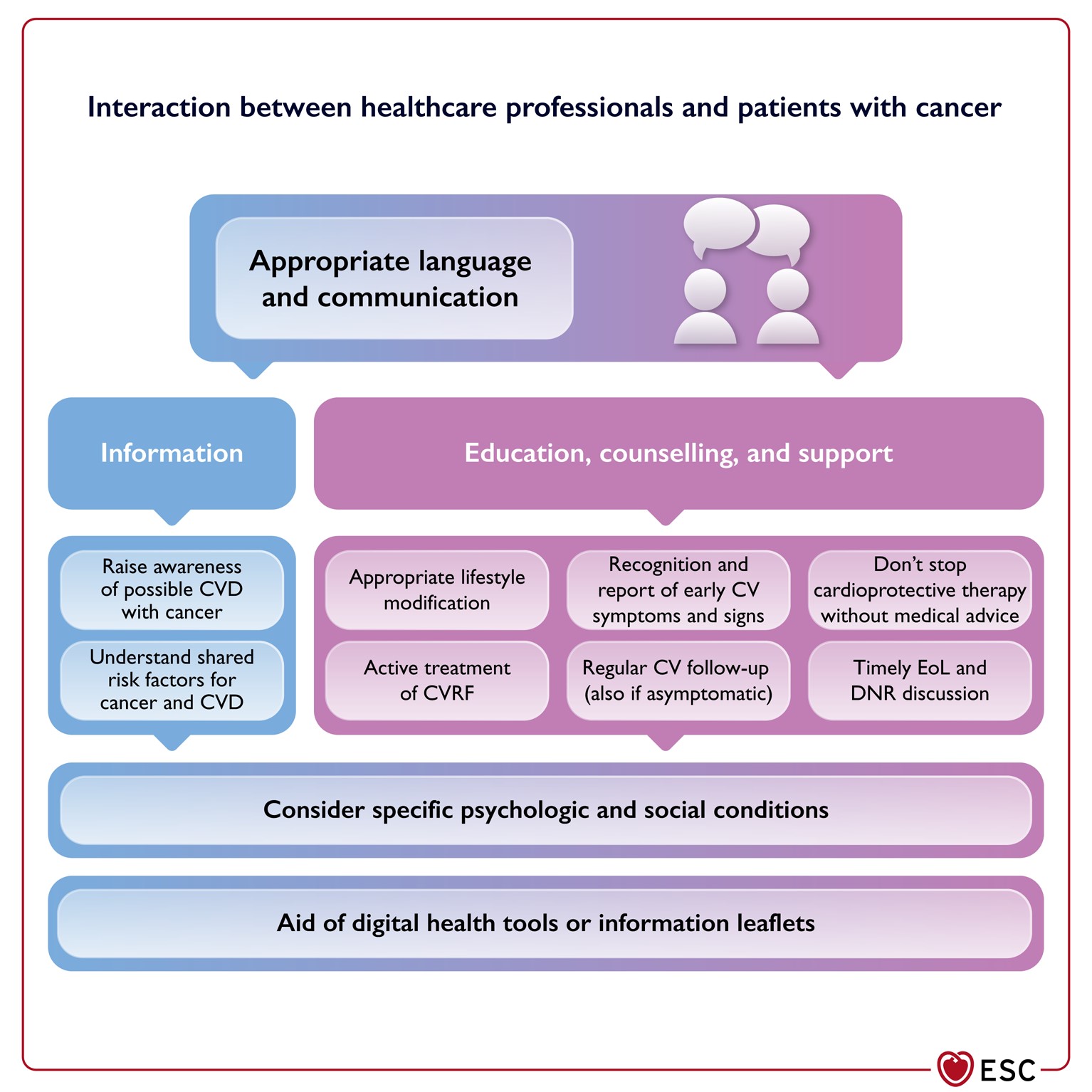
Informazione, comunicazione e autogestione del paziente
fonte: Eur Heart J, ehac244, https://doi.org/10.1093/eurheartj/ehac244
Le "Linee guida ESC sulla Cardio-Oncologia" sono disponibili qui: 2022 ESC Guidelines on cardio-oncology.
La traduzione in italiano non è al momento disponibile.
Su esanum puoi trovare un breve riassunto delle novità più importanti contenute nelle linee guida presentate al Congresso ESC 2022:
- Aritmie ventricolari e morte cardiaca improvvisa
- Valutazione e gestione cardiovascolare dei pazienti sottoposti a chirurgia non cardiaca
- Cardio-Oncologia
- Ipertensione polmonare (disponibile dal 29/10/2022)
La traduzione in italiano tiene conto dei suggerimenti per riportare la forza delle raccomandazioni (classi I, IIa, IIb, III) e il livello delle evidenze (A, B, C), comunque indicati.
Questa sintesi in italiano non è da considerarsi a valenza di linea guida ufficiale. Per la pratica clinica vi invitiamo a prendere visione del testo originale. Per segnalare eventuali suggerimenti scrivici a info@esanum.it.